[Giáo án Hóa học 9] Mời các bạn giải bài tập SGK Hóa học lớp 9 trang 1, 2, 3, 4, 5 trang 25: tính chất hóa học của kiềm
Bạn Đang Xem: Bài 1,2,3,4,5 trang 25 SGK hóa lớp 9: Tính chất hóa học của Bazơ
A. Thuyết tính chất hóa học của bazơ
I. Phân loại cơ bản
Dựa vào độ tan của kiềm trong nước, người ta chia độ kiềm thành hai loại:
– Bazơ tan trong nước tạo thành dung dịch kiềm (gọi là bazơ):
naoh, koh, ba(oh)2, ca(oh)2, lioh, rboh, csoh, sr(oh)2.
– Bazơ không tan:
cu(oh)2, mg(oh)2, fe(oh)3, al(oh)3…
Hai. Tính chất hóa học của bazơ
– Dung dịch kiềm làm đổi màu quỳ tím thành xanh
– Dung dịch kiềm làm dung dịch phenolphtalein không màu chuyển sang màu đỏ.
– Phản ứng với axit: Bazơ tác dụng với axit tạo thành muối và nước. Phản ứng này được gọi là trung hòa.
ca(oh)2 + h2so4 -> caso4 + 2h2o
– Phản ứng với oxit axit: Bazơ tác dụng với oxit axit tạo thành muối và nước.
ca(oh)2 + so2 -> caso3 + 2h2o
– Nhiệt phân hủy bazơ khó tan: tạo thành oxit và nước
b. Giải bài tập Hóa học lớp 9 Bài 7 Trang 25: Tính chất hóa học của bazơ – Chương 1.
Xem Thêm: Hướng dẫn cách kẻ đường thẳng trong word đơn giản
Bài 1. a) Có phải tất cả các cơ sở đều là cơ sở không? Nêu công thức hóa học của ba chất cơ bản.
b) Có phải tất cả các cơ sở đều là cơ bản? Nêu công thức hóa học của ba chất cơ bản.
Hướng dẫn:a) Vì bazơ là bazơ tan trong nước nên mọi bazơ đều là bazơ.
Ví dụ: naoh, koh, ba(oh)2.
b) Vì không phải bazơ nào cũng tan trong nước nên không phải bazơ nào cũng là bazơ.
Xem Thêm : Hướng dẫn học Excel cơ bản cho người mới bắt đầu
Ví dụ: Các bazơ cu(oh)2, mg(oh)2, fe(oh)3 .. không phải là bazơ.
Bài 2 (Kỳ 9 tr. 25):Có các căn sau: cu(oh)2, naoh, ba(oh)2. Hãy cho tôi biết căn cứ nào
a) Dùng dung dịch HCl. b) phân hủy nhiệt.
c) Tác dụng là khí cacbonic. d) Làm đổi màu quỳ tím. chuyển sang màu xanh lá cây.
Hướng dẫn bài 2:a) Tất cả các bazơ đều phản ứng với axit clohiđric:
cu(oh)2 + 2hcl → cucl2 + 2h2o
naoh + hcl → nacl + h2o
ba(oh)2 + 2hcl → bacl2 + 2h2o
b) Chỉ có cu(oh)2 là bazơ khó tan, khi đun nóng sẽ bị phân hủy:
cu(oh)2 t0 → cuo + h2o
Xem Thêm: Nước cứng là gì? Dấu hiệu nhận biết và cách làm mềm nước cứng hiệu quả
c) Bazơ phản ứng được với co2 là naoh và ba(oh)2.
naoh + co2 → na2co3 + h2o
ba(oh)2 + co2 → baco3 + h2o
d) Các bazơ làm quỳ tím chuyển sang màu xanh là naoh và ba(oh)2.
bài 3: Xét về chất khả dụng thì có na2o, cao và h2o. Viết phương trình hóa học của dung dịch bazơ.
Mô tả:Phương trình hóa học để điều chế dung dịch bazơ:
na2o + h2o → 2naoh
cao + h2o → ca(oh)2
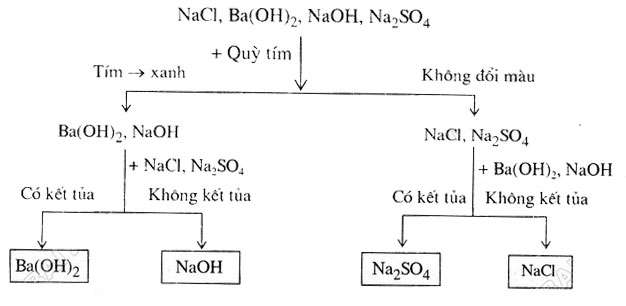
bài 4. Có 4 lọ không nhãn, mỗi lọ chứa các dung dịch không màu sau: nacl, ba(oh)2, naoh, na2so4. Nếu chỉ dùng giấy quỳ tím, có thể nhận biết dung dịch đựng trong mỗi lọ bằng cách nào? Viết phương trình hóa học.
Giải pháp 4: Lấy từ mỗi lọ một mẫu hóa chất (gọi là mẫu thử) để làm thí nghiệm nhận biết.
Cho giấy quỳ tím vào mẫu thử từng chất và quan sát:
Xem Thêm : Cách cảm thụ và phân tích một bài thơ trong Văn học lớp 9
– Dung dịch làm quỳ tím đổi màu là: naoh và ba(oh)2, (nhóm 1).
– Dung dịch không làm đổi màu quỳ tím là: nacl, na2so4 (nhóm 2).
Để nhận biết từng chất trong mỗi nhóm ta lấy một chất ở nhóm (1) rồi cho lần lượt từng chất ở nhóm (2) vào, nếu có kết tủa thì nhóm (1) Chất lấy vào là ba ( ồ)2 và chất ở nhóm (2) là na2so4. Các chất còn lại trong mỗi nhóm sau đó đã được xác định.
Phương trình phản ứng: ba(oh)2 + na2so4 → baso4 + naoh
Xem Thêm: Tổng hợp kiến thức và lời giải bài 11 trang 12 sgk toán 7 tập 1 Dễ
Hoặc bạn có thể làm theo hình bên dưới
Bài 5, trang 25 Hóa học 9: Cho 15,5 gam natri oxit tác dụng với nước thu được 0,5 lít dung dịch kiềm.
a) Viết phương trình hóa học và tính nồng độ mol/l của dung dịch bazơ thu được.
b) Tính thể tích dung dịch h2so4 20% 1,14 g/ml cần dùng để trung hòa dung dịch kiềm trên.
Hướng dẫn giải bài 5:
Số mol na2o = 15,5:62 = 0,25 mol
<3
na2o + h2o → 2naoh
Phản ứng: 0,25 → 0,5 (mol)
500ml=500/1000=0,5L; cm, nah = 0,5/0,5 = 1m.
b) Phương trình phản ứng trung hòa dung dịch:
2naoh + h2so4 → na2so4 + 2h2o
Phản ứng: 0,5 → 0,25 0,25 (mol)
mh2so4 = 0,25×98 = 24,5 gam
mdd h2so4 = 24,5.100/20= 122,5 gam
mdd, ml =mdd,g = dg/ml = 122,5/1,14 ≈ 107,5 ml
Nguồn: https://anhvufood.vn
Danh mục: Giáo Dục
- Thần số học số 5 (Ý nghĩa, tính cách, khả năng tương thích)
- Tết Nguyên Đán: Nguồn gốc, ý nghĩa và những phong tục ngày Tết
- Giving down là gì
- Top 5 địa chỉ khám sức khỏe đi làm nhanh, rẻ, uy tín tại Hà Nội
- Văn mẫu lớp 9: Nghị luận xã hội về ý chí, nghị lực sống của con người Dàn ý & 32 bài văn mẫu lớp 9 hay nhất




