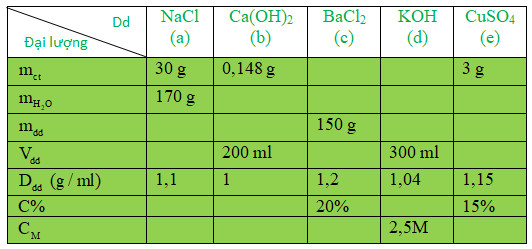
Hướng dẫn đọc bài 16: Tính chất hóa học của kim loại SGK Hóa học 9. Nội dung bài 12 3 4 5 6 7 Trang 51 SGK Hóa học 9 bao gồm đầy đủ lý thuyết, công thức, phương trình hóa học, chuyên đề hóa học,… đều được đưa vào sách giáo khoa giúp học sinh học tốt môn Hóa học lớp 9 và ôn thi vào lớp 10.
Bạn Đang Xem: Hướng dẫn Giải bài 1 2 3 4 5 6 7 trang 51 sgk Hóa học 9
Lý thuyết
Tôi. Phản ứng của kim loại và phi kim
1. Phản ứng với oxy
Hầu hết các kim loại (trừ vàng, bạch kim, bạc…) phản ứng với oxy ở nhiệt độ phòng hoặc nhiệt độ cao để tạo thành oxit.
2. Phản ứng với các phi kim loại khác (cl.,, s,…)
Nhiều kim loại tác dụng với nhiều phi kim tạo thành muối.
Hai. Phản ứng của kim loại với dung dịch axit
Nhiều kim loại tác dụng với dung dịch axit (hcl,…) tạo thành muối và khí hiđro.
Ba. Kim loại tác dụng với dung dịch muối
Các kim loại mạnh hơn (trừ na, k, ba…) tác dụng với muối của kim loại yếu hơn tạo thành muối và kim loại mới.
Dưới đây là lời giải Bài 9 trang 51 SGK Hóa 1 2 3 4 5 6 7. Các em vui lòng đọc kỹ tên bài trước khi giải bài!
Bài tập
giaibaisgk.com giới thiệu đến các bạn đầy đủ phương pháp giải bài tập hóa học 9 có lời giải và đáp án chi tiết sgk hóa học 9 Bài 1 2 3 4 5 6 7 trang 51 để các bạn tham khảo. Về nội dung trả lời chi tiết, đáp án cho từng câu hỏi như sau:
1. Giải bài 1 SGK Hóa học 9 trang 51
Nêu tính chất hóa học của kim loại? Cho ví dụ và viết phương trình hóa học minh họa cho kim loại magie.
Trả lời:
Kim loại có những tính chất hóa học sau:
– Phản ứng với oxi.
Ví dụ: 2mg +o2 \(\xrightarrow{{{t^0}}}\) 2mgo
– Tác dụng với phi kim khác
Ví dụ: mg + cl2 \(\xrightarrow{{{t^0}}}\) mgcl2
– Phản ứng với dung dịch axit
Ví dụ: mg +2 hcl → mgcl2 + h2↑
– Tác dụng của dung dịch muối
Ví dụ: mg + cuso4 → mgso4 + cu
2. Giải bài 2 trang 51 SGK hóa học 9
Viết phương trình hóa học theo sơ đồ phản ứng sau:
a) …………. + hcl \(\xrightarrow{{}}\) mgcl2 + h2;
b) ……… + agno3 \(\xrightarrow{{}}\) cu(no3)2 + ag;
c) ……… + ………… \(\xrightarrow{{}}\) zno;
Xem Thêm: Văn mẫu lớp 9: Tổng hợp mở bài Mùa xuân nho nhỏ (35 mẫu) Mở bài Mùa xuân nho nhỏ của Thanh Hải
d) …….. + cl2 \(\xrightarrow{{}}\) cucl2
e)…….+ s → k2s.
Giải pháp thay thế:
a) mg + 2hcl → mgcl2 + h2 ↑
b) cu + 2agno3 → cu(no3)2 + 2ag↓
c) 2zn + o2 \(\xrightarrow{{{t^0}}}\) 2zno
Xem Thêm : TỪ ĐỒNG NGHĨA TRONG TIẾNG ANH (SYNONYM) LÀ GÌ? TRỌN
d) cu + cl2 \(\xrightarrow{{{t^0}}}\) cucl2
e) 2k + s → k2s.
3. Giải bài 3 trang 51 SGK Hóa học 9
Viết phương trình hóa học của phản ứng xảy ra giữa các cặp chất sau:
a) Kẽm + axit sunfuric loãng;
b) Kẽm + dung dịch bạc nitrat;
c) natri+lưu huỳnh;
d) Canxi + Clo.
Giải pháp thay thế:
Công thức hóa học
a) zn + h2so4 → znso4 + h2
b) zn + 2agno3 → zn(no3)2 + 2ag ↓
c) 2na + s → na2s
d) ca + cl2 \(\xrightarrow{{{t^0}}}\) cacl2
4. Giải bài 4 trang 51 SGK Hóa học 9
Theo tính chất hóa học của kim loại, viết phương trình hóa học biểu thị sự chuyển hóa sau:
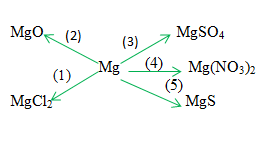
Giải pháp thay thế:
1) mg +cl2 \(\xrightarrow{{{t^0}}}\) mgcl2
Xem Thêm: Hướng dẫn, thủ thuật về Thủ thuật văn phòng
2) 2mg + o2 \(\xrightarrow{{{t^0}}\) 2mgo
3) mg + h2so4 loãng → mg so4 + h2↑
4) mg + 2 agno3 → mg(no3)2 + 2ag↓
5) mg + s → mg ↓
5. Giải bài 5 trang 51 SGK Hóa học 9
Dự đoán hiện tượng và viết phương trình hóa học khi:
a) Đốt cháy dây dẫn trong khí clo.
b) Cho đinh sắt vào ống nghiệm đựng dung dịch cucl2.
c) Nhúng miếng kẽm vào dung dịch cus04.
Giải pháp thay thế:
a)Hiện tượng: Sắt nóng chảy, phát ra các hạt sáng màu thu được fecl3 màu nâu đỏ.
2fe + 3cl2 \(\xrightarrow{{{t^0}}}\) 2fecl3
b)Hiện tượng: Thanh sắt tan dần, sinh ra kim loại màu đỏ bám vào đinh sắt, dung dịch màu xanh nhạt dần.
fe + cucl2 → fecl2 + cu↓ (đỏ)
c) Hiện tượng: vảy kẽm tan dần đến hết, màu xanh của dung dịch cuso4 nhạt dần, xuất hiện kim loại màu đỏ.
Xem Thêm : Những bài thơ hay của Đỗ Phủ sâu lắng, dạt dào cảm xúc
zn + cuso4 → znso4 + cu↓ (đỏ)
6. Trả lời bài 6 SGK Hóa học 9 trang 51
Ngâm lá kẽm trong 20 gam dung dịch đồng sunfat 10% cho đến khi kẽm không tan. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch sau phản ứng.
Giải pháp thay thế:
Ta có:
mcuso4 = 20.0.1 = 2(g)
⇒ ncuso4 = 0,0125 (mol)
pthh: zn + cuso4 ⇒ znso4 + cu ↓
1 nốt ruồi 1 nốt ruồi 1 nốt ruồi
0,0125 Nốt ruồi 0,0125 Nốt ruồi 0,0125 Nốt ruồi
Xem Thêm: Nguyên tử là gì? Nguyên tử được cấu tạo bởi những hạt nào?
⇒ mzn = n.m = 0,0125. 65 = 0,81 (gam)
⇒ mznso4 = n.m = 0,0125. 161= 2,01 (gam)
Ta có:
sau phản ứng mdd = mdd cuso4 + mzn – giải phóng mcu
Nồng độ phần trăm của dung dịch znso4 là:
c% = (2,01/20).100% = 10,05 (%)
7.Giải bài tập 7* tr.51 SGK Hóa học 9
Ngâm lá đồng trong 20 ml dung dịch bạc nitrat cho đến khi đồng không tan nữa. Lấy lá đồng ra, rửa nhẹ, sấy khô, đem cân thì thấy khối lượng lá đồng tăng 1,52 gam. Xác định nồng độ mol của dung dịch bạc nitrat đã dùng (giả sử toàn bộ lượng bạc thoát ra đều bám vào lá đồng).
Giải pháp thay thế:
Phương trình hóa học:
\(cu + {\rm{ }}2agn{o_3} \to cu{({o_3})_2} + 2ag{\rm{ }} \downarrow \)
Theo pthh:
Phản ứng của 1 mol cu với 2 mol agno3 làm khối lượng tăng thêm 152 gam
x mol cu phản ứng với 2x mol agno3 thì khối lượng tăng 1,52 gam
Suy luận:
\(\rightarrow x = {1,52\over 152}=0,01\, (mol)\)
\( \rightarrow {n_{agn{o_3}}} = 2.0,01=0,02{\rm{ }}\left( {mol} \right)\)
Nồng độ dung dịch agno3:
\(c{m_{agn{o_3}}} = {n \over v} = {\rm{ }}{{0,02} \over {0,02}} = 1 left( m \phải)\)
Trước:
- Hướng dẫn giải 1 2 3 4 5 Trang 48 SGK Hóa học 9
- Hướng dẫn giải 1 2 3 4 5 tr.54 SGK Hóa học 9
- Giải các bài toán hóa học lớp 9 khác
- Học tốt môn toán lớp 9
- Học tốt vật lý lớp 9
- Học tốt môn sinh học lớp 9
- Học tốt ngữ văn lớp 9
- Điểm tốt môn lịch sử lớp 9
- Học tốt môn địa lý lớp 9
- Học tốt tiếng Anh lớp 9
- Tiếng Anh lớp 9 thí điểm
- Học Khoa học Máy tính Lớp 9
- Học tốt GDCD lớp 9
Tiếp theo:
Xem thêm:
Trên đây là hướng dẫn Giải bài trang 1 2 3 4 5 6 7 51 SGK Hóa 9 đầy đủ và ngắn gọn nhất. Chúc các bạn làm tốt bài kiểm tra hóa học lớp 9!
“Bài tập nào khó, đã có giabaisgk.com”
Nguồn: https://anhvufood.vn
Danh mục: Giáo Dục
- Mơ thấy người thân trong gia đình đánh con gì? Giải mã giấc mơ thấy người thân
- Thứ tự bảng chữ cái tiếng việt như thế nào? Bí quyết giúp bé học chữ cái hiệu quả
- Cụm di tích lịch sử Cầu Hiền Lương – Sông Bến Hải
- Cách trang trí nhà play together đẹp cho người mới [hướng dẫn chi tiết]
- Bộ đề thi giữa học kì 2 môn Ngữ văn lớp 6 năm 2021 – 2022 (Sách mới) 12 Đề kiểm tra giữa kì II môn Ngữ văn 6 (Có đáp án Ma trận)