Có thể bạn quan tâm
- Những trò lố hay là Va-ren và Phan Bội Châu – Ngữ văn lớp 7
- Văn mẫu lớp 12: Tổng hợp mở bài về tác phẩm Chiếc thuyền ngoài xa (62 mẫu) Mở bài Chiếc thuyền ngoài xa
- Bài văn mẫu lớp 9: Bài viết số 7 (Đề 1 đến Đề 7) Tuyển tập 85 bài văn mẫu lớp 9 hay nhất
- Dàn ý phân tích bài Hai đứa trẻ chi tiết nhất (5 Mẫu) – Văn 11
- Nghị luận xã hội 200 chữ suy nghĩ về tuổi trẻ
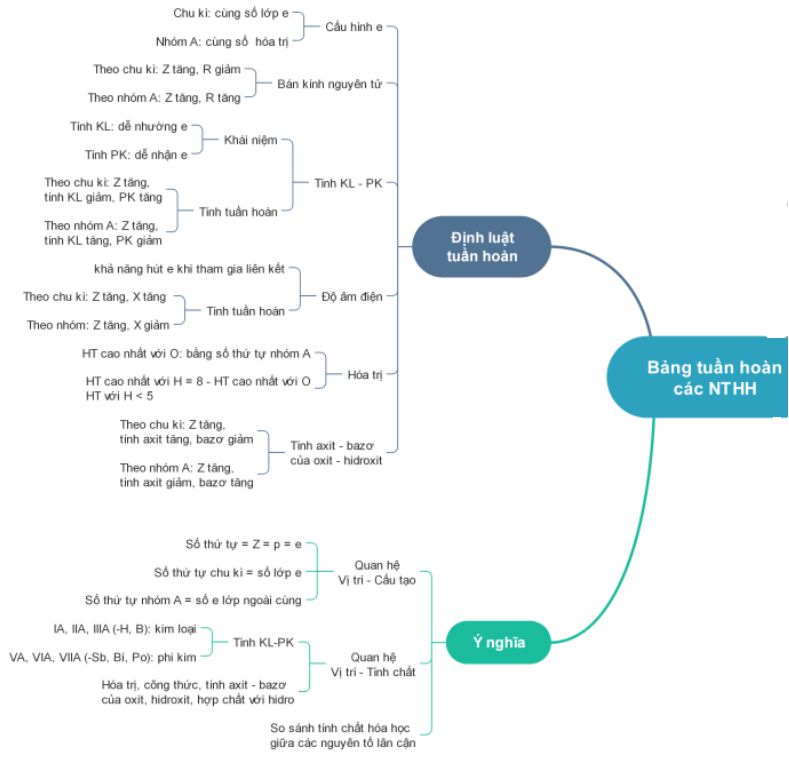
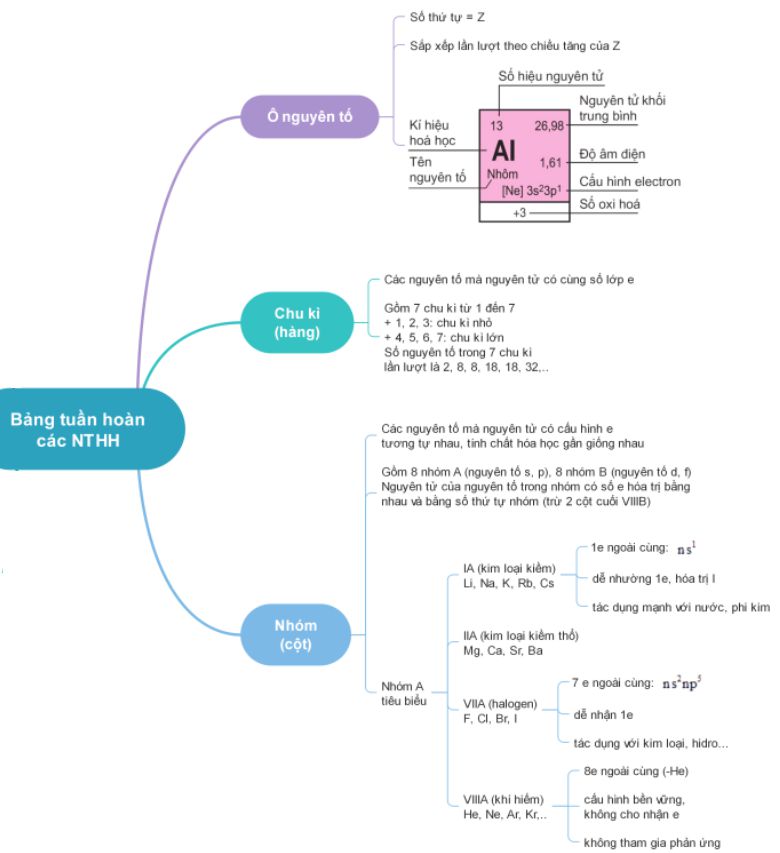
A. Sơ Đồ Tư Duy 10 Chương 2: Bảng Tuần Hoàn Các Nguyên Tố Hóa Học
 .
.
Bạn Đang Xem: Sơ đồ tư duy Hóa 10 chương 2 Bảng tuần hoàn
b. Lý Thuyết 10 Chương Ngắn Nhất 2
i – Bảng tuần hoàn các nguyên tố hóa học
1. Quy tắc sắp xếp
– Các nguyên tố được sắp xếp theo chiều điện tích hạt nhân tăng dần.
– Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
– Các nguyên tố có cùng electron hóa trị trong nguyên tử xếp thành hàng.
2. Cấu trúc của bảng tuần hoàn
a/ Ô nguyên tố: Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố.
b/ chu kì: Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần. Số thứ tự của chu kỳ tương ứng với số lớp electron của các nguyên tố trong chu kỳ.
- Các vòng nhỏ: bao gồm các vòng 1, 2 và 3.
- Chu kỳ lớn: gồm các chu kỳ 4, 5, 6, 7.
c/ Nhóm nguyên tố: Là tập hợp các nguyên tố mà nguyên tử của chúng có cấu hình electron tương tự nhau nên có tính chất hóa học gần giống nhau, được xếp thành một hàng.
d/ khối phần tử:
- Chất của nguyên tố s: gồm các nguyên tố thuộc họ ia và iia. nguyên tố s là những nguyên tố có nguyên tử electron cuối cùng được điền vào phân lớp s.
- Khối lượng của nguyên tố p: gồm các nguyên tố từ nhóm iiia đến nhóm viiia (trừ he). nguyên tố p là những nguyên tố có electron cuối cùng được điền vào phân lớp p.
- Khối lượng của nguyên tố d: gồm nhóm nguyên tố b. Các nguyên tố d là những nguyên tử có electron cuối cùng được điền vào phân lớp d.
- Khối phần tử f: Bao gồm lantanit và actinua. Phần tử f là phần tử có các electron cuối cùng để lấp đầy phân lớp f.
ii – Thay đổi định kỳ một số thuộc tính nhất định của một phần tử
1. Nhóm các phần tử a: phần tử s và p
– Số thứ tự nhóm = số electron hoá trị = số electron lớp ngoài cùng.
– Khi điện tích hạt nhân tăng, sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố là nguyên nhân dẫn đến sự biến đổi tuần hoàn tính chất của nguyên tố.
2. Phần tử nhóm b: phần tử d và f. (kim loại chuyển tiếp)
– Cấu hình electron nguyên tử có dạng: (n – 1)dans2 (a = 1 → 10)
– Số electron hóa trị = số n electron lớp vỏ + số (n – 1)d electron chưa no.
– Đặt s = a + 2, ta có:- s ≤ 8 thì s = số nhóm.
– 8 ≤ s 10 thì phần tử thuộc nhóm viii b.
3. Phép biến đổi một số đại lượng vật lý
a/ Sự thay đổi bán kính nguyên tử theo chiều tăng điện tích hạt nhân:
– Đồng thời: bán kính giảm.
– Trong cùng một nhóm a : Bán kính tăng.
Sự biến thiên năng lượng ion hóa thứ nhất của các nguyên tố nhóm b/a: khi điện tích hạt nhân tăng:
– Năng lượng ion hóa tăng trong cùng thời gian.
– Trong cùng một nhóm, năng lượng ion hóa giảm dần.
– Năng lượng ion hóa thứ nhất (i1) của nguyên tử là năng lượng tối thiểu cần thiết để bứt electron đầu tiên ra khỏi nguyên tử ở trạng thái cơ bản. (tính bằng kJ/mol)
4. Độ âm điện
Độ âm điện của nguyên tử là đại lượng đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hoá học.
Khi điện tích hạt nhân tăng:
- Trong cùng khoảng thời gian đó, độ âm điện tăng dần.
- Trong cùng một nhóm, độ âm điện giảm dần.
5. Sự thay đổi tính chất kim loại-phi kim
a/ Trong cùng khoảng thời gian đó, khi điện tích hạt nhân tăng dần thì:
* Tính kim loại giảm, tính phi kim tăng.
b/ Trong cùng một nhóm a, khi điện tích hạt nhân tăng:
* Tính kim loại tăng, tính phi kim giảm.
6. Thay đổi giá trị
Trong cùng khoảng thời gian đó, khi điện tích hạt nhân tăng thì hóa trị cao nhất của oxi tăng từ 1 lên 7 và hóa trị cao nhất của hiđro giảm từ 4 xuống 1.
Hóa trị của hydro = số nhóm – hóa trị của oxy
Công thức phân tử của một nhóm nguyên tố (r: là một nguyên tố)
r2on: n là số nhóm.
rh8-n: n là số nhóm.
nhóm
Có
Tôi là
iii
va
Có
Đạt
Đạt
Oxit
r2o
Ro
r2o3
Xem Thêm : Văn mẫu lớp 11: Phân tích truyện ngắn Chí Phèo của Nam Cao Dàn ý & 15 bài phân tích bài Chí Phèo
ro2
r2o5
ro3
r2o7
Hydrua
rh4
rh3
rh2
tay phải
7. Sự biến đổi axit-bazơ của oxit và hiđroxit
a/ Đồng thời khi điện tích hạt nhân tăng: tính kiềm giảm, tính axit tăng.
b/ Trong cùng một phân nhóm a, khi điện tích hạt nhân tăng: tính kiềm tăng, tính axit giảm.
Tóm tắt
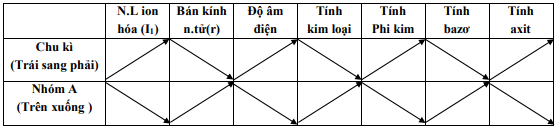
8. Định luật tuần hoàn các nguyên tố hóa học
Các nguyên tố và tính chất của chúng cũng như thành phần và tính chất của hợp chất gồm các nguyên tố này biến đổi tuần hoàn theo chiều điện tích hạt nhân tăng dần
Ba. Mối quan hệ giữa vị trí nguyên tố và cấu tạo nguyên tử
1. Mối quan hệ cấu hình và vị trí trong htth.
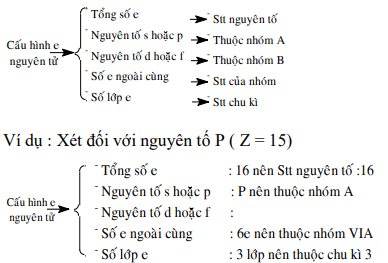
2. Mối quan hệ giữa vị trí phần tử và thuộc tính phần tử.
Vị trí phần tử được suy luận:
– thuộc nhóm kim loại (ia, iia, iiia) ngoài b và h.
– Hóa trị cao nhất của oxit và hợp chất chứa hiđro.
– Oxit cao và hợp chất chứa hiđro.
– Tính axit, tính bazơ của oxit và hiđroxit.
Ví dụ: cho s ở ô 16: Suy ra:
– s trong nhóm vi, ck3, pk
– Hóa trị cao nhất là 6 đối với oxy và 2 đối với hydro.
– Oxit cao nhất của ct là so3, hợp chất với hiđro là h2s.
– so3 là oxit axit còn h2so4 là axit mạnh.
3. So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận.
A. Trong thời kỳ điện tích hạt nhân tăng lên, cụ thể là về:
Tính kim loại yếu đi, tính phi kim tăng lên.
Oxit và hiđroxit trở nên kém bazơ hơn và có tính axit hơn.
Ở nhóm a, chiều điện tích hạt nhân tăng dần, cụ thể:
– Tính kim loại càng mạnh, tính phi kim càng yếu.
-ring: si phi kim<; p<
– Phân theo nhóm a: phi kim loại như
p<
4. Hãy cẩn thận khi định vị các phần tử của nhóm b.
A. Các phần tử của nhóm d: (n-1)dansb với a = 1à10 ; b = 1 à 2
+ nếu a + b <; 8 → a + b là số nhóm.
+ nếu a + b > 10 → (a + b) – 10 là số nhóm.
+ if 8 a + b 10 → viii phần tử nhóm b
Phần tử họ F: (n-2)fansb, trong đó a = 1 à 14; b = 1 à 2
+ Nếu n = 6 → Lantanit.
+ nếu n = 7 → actinit.
(a + b) – 3 = số thứ tự của phần tử trong họ
Ví dụ: z = 62 ; n = 6, a = 6, b = 2 → 6 + 2 – 3 = 5 , thuộc ô đơn vị thứ 5 của dãy lantanit.
c. Trắc nghiệm 10 chương 2 có đáp án đầy đủ
b1. Biết độ (5 câu)
Câu 1:Chu kỳ là dãy các phần tử có cùng phần tử
- Số lớp electron.
- Số electron hóa trị
- Proton.
- Số điện tích hạt nhân.
Câu 2:Các nguyên tố trong bảng tuần hoàn của Mendeleev được sắp xếp theo thứ tự tăng dần
- Khối lượng nguyên tử.
- Bán kính nguyên tử
- Số hiệu nguyên tử
- Độ âm điện của nguyên tử.
Câu 3:Các nguyên tố trong bảng tuần hoàn này được sắp xếp theo thứ tự tăng dần
- Khối lượng nguyên tử.
- Bán kính nguyên tử
- Số hiệu nguyên tử.
- Độ âm điện của nguyên tử.
Xem Thêm: Ý nghĩa hình xăm Geisha Nhật Bản, 49 mẫu cô gái cầm ô đẹp
Câu 4:Trong nhóm a (phân nhóm chính), trừ nhóm viiia (phân nhóm chính nhóm viii), chiều điện tích hạt nhân tăng dần
- Tính phi kim giảm và bán kính nguyên tử tăng.
- Khi tính kim loại tăng, độ âm điện tăng.
- Độ âm điện giảm dần, tính phi kim tăng dần.
- Tính kim loại tăng thì bán kính nguyên tử giảm.
Câu 5: Từ nguyên tố li đến f, chiều điện tích hạt nhân tăng dần
- Bán kính nguyên tử và độ âm điện đều tăng
- Bán kính nguyên tử tăng, độ âm điện giảm
- Bán kính nguyên tử giảm, độ âm điện tăng
- Bán kính nguyên tử và độ âm điện đều giảm
b2. Mức độ hiểu (5 câu)
Câu 6: Các số nguyên tố thuộc chu kì 2, 4, 6 là
- 8, 18, 32.
- 2, 8, 18.
- 8, 18, 18.
- 8, 10, 18.
Xem Thêm : Ý nghĩa và hậu quả của hành động thương cho roi cho vọt?
Câu 7: Chọn câu không là đúng
- Các nguyên tử nguyên tố cùng chu kỳ có cùng số lớp electron.
- Tính chất hóa học của các nguyên tố cùng thời kì nhìn chung giống nhau.
- Nguyên tử của các nguyên tố trong cùng một nhóm thường có số electron lớp ngoài cùng bằng nhau.
- Các thuộc tính của cùng một nhóm phần tử là tương tự nhau.
Câu 8: Ở trạng thái cơ bản, cấu hình electron nguyên tử của nguyên tố x là 1s22s22p63s23p4. Vị trí của nguyên tố x trong bảng tuần hoàn là
- Tập 16, Tập 3, Nhóm iva.
- Nhóm 16, vấn đề 3, nhóm đã thông qua.
- Tập 16, tập 3, nhóm ivb.
- Số 16, số 3, rung nhóm.
Câu 9: Cấu hình electron của nguyên tử x: 1s22s22p63s23p5. Hydroxide cao
Hầu hết đều có biểu mẫu
- hx, x2o7.
- h2x, xo3
- xh4, xo2
- h3x, x2o5
Câu 10: Anion x- và cation y2+ đều có cấu hình electron lớp ngoài cùng là 3s23p6. Vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hóa học là:
- x có số thứ tự 17, chu kỳ 4, nhóm viia (phân nhóm chính vii); y có số thứ tự 20, chu kỳ 4, nhóm iia (phân nhóm chính ii).
- x có số thứ tự 18, chu kỳ 3, nhóm via (phân nhóm chính của vi); y có số thứ tự 20, chu kỳ 4, nhóm iia (phân nhóm chính ii).
- x có số thứ tự 17, chu kỳ 3, nhóm viia (phân nhóm chính vii); y có số thứ tự 20, chu kỳ 4, nhóm iia (phân nhóm chính ii).
- x là thứ tự 18, chu kỳ 3, nhóm viia (phân nhóm chính vii); y là thứ tự 20, chu kỳ 3, nhóm iia (phân nhóm chính ii).
b3. Mức độ vận dụng thấp (5 câu)
Bài 11: Thứ tự các nguyên tố từ trái sang phải theo chiều tăng dần tính phi kim là:
- n,p,o,f.
- p, n, f, o.
- n, p, f, o.
- p, n, o, f.
Tiết 12Bán kính nguyên tử của các nguyên tố: 3li, 8o, 9f, 11na theo thứ tự tăng dần từ trái sang phải
- li, na, o, f.
- f, o, li, na.
- f, li, o, na.
- f, na, o, li.
Câu 13: Các phần tử m (z = 11), x (z = 17), y (z = 9) và r (z = 19). Độ âm điện của các nguyên tố tăng dần theo thứ tự
- m <; x < y <r
- r<;m<x<y.
- y <;m< x <sông
- m <; x < r < Đúng.
Câu 14: Các nguyên tố: k (z = 19), n (z = 7), si (z = 14), mg (z = 12). Thứ tự của các nguyên tố theo thứ tự giảm dần bán kính nguyên tử từ trái sang phải là:
- n, si, mg, k.
- k, mg, si, n.
- k, mg, n, si.
- mg, k, si, n.
câu 15: các kim loại x, y, z có cấu hình electron lần lượt là: 1s22s22p63s1 Các kim loại x, y, z có cấu hình electron là;1s22s22p63s2;1s22s22p63s23p1. Thứ tự tăng dần tính khử của các kim loại từ trái sang phải là:
- z, x, y.
- y, z, x.
- z, y, x.
- x, y, z.
b4. Mức độ vận dụng cao (5 câu)
Câu 16: Công thức phân tử của hợp chất khí gồm nguyên tố r và hiđro là rh3. Trong oxit có hóa trị r cao nhất thì oxi chiếm 74,07% khối lượng. Phần tử r là
- Tiếng kèn.
- Như.
- n.
- p.
Câu 17: Cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố x là ns2np4. Trong hợp chất khí của nguyên tố x và hiđro thì x chiếm 94,12% theo khối lượng. Phần trăm khối lượng của nguyên tố x trong oxit cao nhất là
- 50,00%.
- 27,27%.
- 60,00%.
- 40,00%.
Câu 18: Nguyên tố y là phi kim thuộc chu kì 3 có công thức oxit cao nhất là yo3. Nguyên tố y và kim loại m tạo thành hợp chất có công thức hóa học my, trong đó m chiếm 63,64% theo khối lượng. kim loại m là
- zn
- cu
- mg
- Có
Câu 19: Phần trăm khối lượng của nguyên tố r trong hợp chất khí chứa hiđro (r có số oxi hóa thấp nhất) và oxit cao nhất lần lượt là a% và b%, trong đó a : b = 11 : 4. Phát biểu nào sau đây đúng?
- Phân tử oxit cao nhất của R là chất không phân cực.
- Nguyên tử r (ở trạng thái cơ bản) có 6 electron s.
- Thông thường oxit cao nhất của r là chất rắn.
- Trong bảng tuần hoàn các nguyên tố hóa học, r ở chu kỳ thứ ba.
câu 20:x và y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm liên tiếp a. Nguyên tử y có nhiều proton hơn nguyên tử x. Tổng số hạt proton trong nguyên tử x và y là 33. Phát biểu nào sau đây về x và y là đúng?
- Độ âm điện của x lớn hơn của y.
- Nguyên tố x là chất khí ở điều kiện thường.
- Nguyên tử y có 5 electron ở lớp vỏ ngoài cùng (ở trạng thái cơ bản).
- Nguyên tử x (trạng thái cơ bản) có 4 electron ở lớp vỏ ngoài cùng.
Trả lời:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
Một
Một
c
Một
c
Một
b
b
Một
c
đ
b
b
b
c
c
đ
đ
Một
đ
Xem Thêm: Điểm chuẩn Học viện Cảnh sát Nhân dân năm 2021
Nguồn: https://anhvufood.vn
Danh mục: Giáo Dục





