Cấu hình electron nguyên tử là một phần rất quan trọng trong môn hóa học lớp 10 cũng như học sinh lớp 11 và 12. Tuy nhiên, một số học sinh vẫn chưa hiểu và nắm vững điều này. Hãy cùng tìm hiểu thông tin cụ thể dưới đây về cấu hình nguyên tử của từng nguyên tố. Đảm bảo họ sẽ giúp bạn học nhanh hơn và hiệu quả hơn. Vì chúng tôi đã đầu tư xây dựng tất cả 118 nguyên tố hóa học trong bảng tuần hoàn các nguyên tố hóa học.
- Thịt bò hấp với gì ngon nhất? TOP 20 món thịt bò hấp ngon sang chảnh
- Cách làm chân gà sốt thái chua cay ngon bất bại trong lần đầu tiên
- Cách làm lạc rang nước mắm ngon thơm bằng 2 kiểu chế biến đỉnh này
- Trứng vịt lộn bao nhiêu calo? Trứng vịt lộn luộc bao lâu thì chín?
- Cách làm ếch nấu dọc mùng mới lạ, bổ dưỡng thiết đãi cả gia đình
Cấu hình electron của nguyên tử gồm những thành phần nào?
Cấu hình điện tử hay cấu hình electron của nguyên tử được hiểu là sự phân bố của các electron trong lớp vỏ của nguyên tử ở các trạng thái năng lượng hoặc sự hiện diện khác nhau.
Bạn Đang Xem: Cấu Hình Electron Nguyên Tử

– & gt; Xem Thêm : Bảng tuần hoàn hóa học
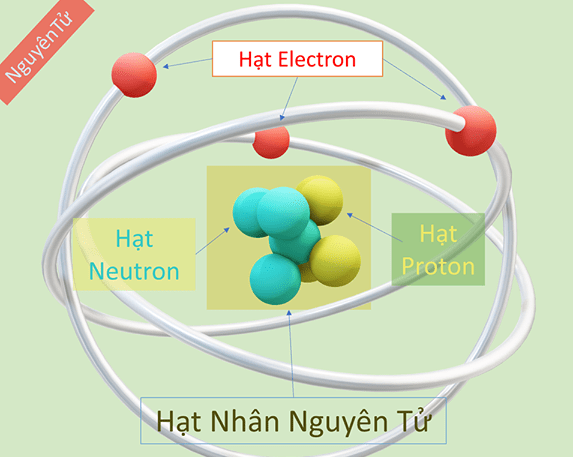
Chúng ta có thể coi nguyên tử như một quả cầu cực nhỏ với đường kính chỉ khoảng 0,00000001 cm, bao gồm các proton, neutron và electron (e). Trong số đó, các electron được sắp xếp theo chiều tăng dần năng lượng và thứ tự phân lớp là s, p, d, f.
Ví dụ: Cấu hình điện tử của một số phần tử phổ biến
Vì vậy, cấu hình electron của nguyên tử là một dãy số biểu thị các obitan electron. Nhờ cấu hình electron, bạn có thể nhanh chóng xác định số lượng electron obitan trong nguyên tử và số electron trong mỗi obitan.
Vỏ điện tử
Nói về lớp vỏ electron, đây là một số điều quan trọng cần nhớ:
- Các electron trong cùng một lớp vỏ có năng lượng gần bằng nhau
- Trong mỗi lớp vỏ electron, có thể có một hoặc nhiều vùng.
- Năng lượng của êlectron phụ thuộc vào khoảng cách từ êlectron đến hạt nhân. Electron càng xa hạt nhân thì năng lượng của nó càng lớn
Số lượng nhóm và số electron tối đa trên mỗi lớp như sau:
– Ghi nhớ số electron và ao trong lớp vỏ thứ n (n £ 4) theo quy tắc sau:
- lớp thứ n có n2 ao
- lớp vỏ thứ n có tối đa 2n2 electron
- lớp k (n = 1): Có 1 lớp con, được ghi là 1s
- Lớp l (n = 2): có 2 lớp con, ký hiệu là 2s và 2p
- Lớp m (n = 3): có 3 lớp con, ký hiệu là 3s, 3p và 3d
- Chỉ 1 lớp con ao ns
- Phân lớp np với 3 ao
- Lớp con có 5 ao
- Phân lớp nf với 7 ao
- Bước 1: Đầu tiên xác định số electron trong nguyên tử.
- Bước 2: Sau đó, sắp xếp các electron theo thứ tự tăng dần của mức năng lượng: 1s 2s 2p 3s 3p 4s 3d 4p 5s…
- Bước 3: Sắp xếp theo lớp (1 → 7). Trong mỗi lớp theo thứ tự của mỗi phân lớp (s → p → d → f). Ví dụ: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s…
- Bạn cần xác định đúng số electron cho một nguyên tử hoặc ion (Số electron (e) = Số proton (n) = z).
- Cần hiểu các nguyên tắc và quy tắc của các lớp và lớp con
- Cấu hình điện tử ổn định và bão hòa nửa bão hòa của d khi các điện tử lấp đầy vỏ con 4 đạt đến độ bão hòa (d, f) hoặc nửa bão hòa (d, f).
- Bước 1: Xác định e = z = 11
- Bước 2: Sắp xếp các electron theo thứ tự tăng dần: 1s2 2s2 2p6 3s1
- Bước 3: Viết cấu hình electron: 1s2 2s2 2p6 3s1.
- Trong mỗi vỏ con, sự phân bố điện tử sao cho số lượng điện tử chưa ghép đôi là tối đa. Các electron điền vào các obitan theo thứ tự từ trái sang phải.
- Trong một đơn vị quỹ đạo, điện tử đầu tiên được biểu diễn bằng mũi tên hướng lên và điện tử thứ hai được biểu thị bằng mũi tên hướng xuống.
- Cấu hình electron nguyên tử của nguyên tử o (z = 8) là 1s2 2s2 2p4.
- o như sau
Vỏ con điện tử
Ngoại trừ lớp vỏ electron thứ nhất, mỗi lớp electron được chia thành các lớp vỏ con theo nguyên tắc: các electron thuộc cùng một lớp vỏ con có cùng năng lượng.
-Số và ký hiệu của các vỏ con của một lớp vỏ: lớp vỏ electron thứ n có n lớp vỏ con, được biểu diễn bằng ns, np, nd, nf, v.v., như sau:
– Số lượng ao trong mỗi lớp con:
– Số lượng electron trong mỗi vỏ con được biểu thị bằng số ở trên, ở bên phải của ký hiệu vỏ con. Vỏ con có nhiều electron nhất được gọi là vỏ con bão hòa.
– số electron tối đa trong mỗi vỏ con
Trình tự các mức năng lượng nguyên tử
Nếu cùng một vỏ con, các electron ở các obitan khác nhau có cùng năng lượng. Các mức năng lượng nguyên tử được liệt kê theo thứ tự tăng dần.
Ở trạng thái cơ bản, các electron trong nguyên tử lần lượt chiếm các mức năng lượng từ thấp đến cao.
Từ trong ra ngoài, mức năng lượng của các lớp tăng từ 1 đến 7 theo thứ tự tăng dần. Năng lượng của các lớp lần lượt là s, p, d, f. (1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p)
Lưu ý: Khi điện tích hạt nhân tăng lên, có sự chèn mức năng lượng, do đó mức 4s thấp hơn mức 3d.
Quy tắc viết cấu hình electron nguyên tử đúng
Xem Thêm : Cách làm cơm gà xối mỡ ngon thơm lừng, ăn hết trong nháy mắt
Để viết cấu hình electron, trước tiên chúng ta cần biết các nguyên tắc và quy tắc sau:
+ Nguyên lý Pauli: Một quỹ đạo nguyên tử có thể chứa tối đa hai điện tử, chúng quay theo các hướng khác nhau xung quanh trục của mỗi điện tử.
Quy tắc
+ hund: Trong cùng một vỏ con, các electron sẽ được phân bố theo các obitan sao cho số electron chưa ghép đôi là lớn nhất và các electron này phải có cùng hướng quay.
+ Nguyên tắc ổn định: Ở trạng thái cơ bản, trong nguyên tử, các electron chiếm các obitan từ mức năng lượng thấp đến cao
Cấu hình electron biểu thị sự phân bố của các electron theo các lớp và các lớp con. Vì vậy, khi bạn viết, bạn tuân theo các quy tắc sau:
– Quy tắc 1: Điền vào các electron theo thứ tự mức năng lượng từ thấp đến cao (chuỗi klechkovski):
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6 giây…
Tức là, bạn lấp đầy vỏ con bằng các electron bão hòa trước, sau đó lấp đầy vỏ con thứ hai.
-Quy tắc 2: Sắp xếp lại các lớp con sao cho số lớp (n) tăng từ trái sang phải và các lớp con trong cùng một lớp theo thứ tự là s, p, d, f.
Ví dụ, z = 26 cho nguyên tử fe. Sau khi điền vào dãy klechkovski bằng các electron, bạn sẽ nhận được một dãy không đầy đủ 1s22s22p63s23p64s23d6. Bạn sắp xếp lại các ô con 4s2 và 3d6 để có cấu hình electron là 1s22s22p63s23p63d64s2.
+ Cấu hình electron cho biết thứ tự mức năng lượng của các electron giữa các vỏ con. Năng lượng electron trong mỗi vỏ con tăng từ trái sang phải.
Ví dụ, cấu hình electron nguyên tử của oxy là 1s22s22p4. Trong nguyên tử oxy, năng lượng của các electron trong vỏ con 2s cao hơn năng lượng của các electron trong vỏ con 1s. Năng lượng electron lớp vỏ 2p cao hơn năng lượng electron lớp vỏ 2s.
-> Xem thêm: Dãy điện hóa của kim loại
Cách viết cấu hình electron chính xác
Sau khi nắm được những kiến thức trên, công việc tiếp theo là viết cấu hình electron nguyên tử đơn giản và dễ nhớ.
– Lưu ý khi viết cấu hình điện tử:
– Ví dụ, hãy viết cấu hình electron của nguyên tố sau: na (z = 11)
Cách biểu diễn cấu hình electron trong quỹ đạo
biểu diễn cấu hình của electron trên obitan, còn được gọi là biểu diễn cấu hình của pin lượng tử, là một cách biểu diễn sự phân bố của electron theo obitan. Từ đó, bạn sẽ biết một nguyên tử có bao nhiêu electron chưa ghép đôi và quỹ đạo nào mà electron chưa ghép đôi đó đang ở trong.
Các quy tắc cần nhớ khi biểu diễn cấu hình electron trong obitan:
– Quy tắc 1: Viết cấu hình electron của nguyên tử
Xem Thêm : Cách ủ nước vo gạo tưới cây – những mẹo đơn giản giúp cây phát triển tốt
– Quy tắc 2: Biểu diễn mỗi ao bằng một hình vuông (quỹ đạo hoặc đơn vị lượng tử). Đối với các ao trong cùng một phân lớp, chúng được viết cạnh nhau. Phân loại với các ao khác, ghi riêng. Các obitan được sắp xếp từ trái sang phải theo thứ tự cấu hình electron.
– Quy tắc 3: Điền vào mỗi đơn vị quỹ đạo các electron theo thứ tự các lớp và các ô con, mỗi electron được biểu diễn bằng một mũi tên.
Lưu ý:
Ví dụ:
Cấu hình quỹ đạo của
Do đó, nguyên tử oxi có 2 electron độc thân và thuộc nhóm 2p.
Ngoài ra, bạn cần biết rằng các electron mang điện tích âm, vì vậy 2 electron trong cùng một ao sẽ đẩy nhau. Chúng có xu hướng tách biệt và chiếm giữ 2 ao khác nhau. Vì vậy, tóm lại, các electron cần được sắp xếp để tối đa hóa số electron chưa ghép đôi.
Các tính chất hóa học được dự đoán từ cấu hình electron
Cấu hình electron đóng vai trò quyết định đến tính chất hóa học đặc trưng của nguyên tố. Từ cấu hình này, bạn có thể dự đoán nó dựa trên các quy tắc sau:
– Quy tắc 1:
Nguyên tử có 1, 2 hoặc 3 electron ở lớp vỏ ngoài cùng thường là nguyên tử kim loại. Tính chất kim loại được thể hiện bằng khả năng nhường electron trong phản ứng hóa học (sự khử).
Ví dụ: Nguyên tử na (z = 11) có 1 electron ở lớp vỏ ngoài cùng, vậy na là nguyên tố kim loại.
– Quy tắc 2:
Các nguyên tử có 5, 6 hoặc 7 electron ở lớp vỏ ngoài cùng thường là các nguyên tố phi kim. Tính phi kim được biểu hiện bằng khả năng nhận electron trong các phản ứng hoá học (oxi hoá).
ví dụ: Nguyên tử o (z = 8) có 6 electron ở lớp vỏ ngoài cùng nên o là nguyên tố phi kim.
– Quy tắc 3:
Nguyên tử có 8 electron ở lớp vỏ ngoài cùng của chúng (trừ he, chỉ có 2 electron) là nguyên tử nguyên tố khí cao quý. Các nguyên tố này khó tham gia phản ứng hóa học (trơ).
Ví dụ: Nguyên tử ne (z = 10) có 8 electron ở lớp vỏ ngoài cùng, vậy ne là nguyên tố khí cao quý.
– Quy tắc 4:
Nếu một nguyên tử có 4 electron ở lớp vỏ electron ngoài cùng của nó thì nguyên tử của nguyên tố đó có thể là kim loại hoặc phi kim loại.
Kết luận
Điều này sẽ cung cấp cho bạn ý tưởng về cách cấu hình electron được hình thành. Viết các quy tắc để cấu hình điện tử chính xác nhất. Hơn nữa, dựa trên cấu hình này, các thuộc tính của phần tử cũng có thể được dự đoán. Hy vọng những thông tin trên sẽ giúp bạn học tốt hơn.
Nguồn: https://anhvufood.vn
Danh mục: Góc Chia Sẻ
- Bài thơ Sang thu – Tác giả tác phẩm (mới 2022) | Ngữ văn lớp 9
- Tập làm văn lớp 5: Tả một loại hoa mà em thích nhất Dàn ý & 85 bài văn tả hoa lớp 5 hay nhất
- Nhân vật văn học và vai trò của nhân vật trong tác phẩm
- Tổng hợp tất cả công thức môn Vật lý lớp 9 theo từng chương
- Tiêu chuẩn cơ sở là gì? Hướng dẫn xây dựng tiêu chuẩn cơ sở cho sản phẩm




![[Review] Yến sào Đà Nẵng Winsky có tốt không, giá bao nhiêu?](https://anhvufood.vn/wp-content/uploads/review-yen-sao-da-nang-winsky-co-tot-khong-gia-bao-nhieu.jpg)
