Bài 27: Trí Nhớ Lý Thuyết Và Đáp Án Bài 1, 2, 3, 4, 5, 6 SGK Hóa Học Trang 8: Các Phản Ứng Điều Chế-Phân Hủy Oxi
Bạn Đang Xem: Bài 1,2,3, 4,5,6 trang 94 SGK Hóa 8: Điều chế khí oxi
1. Sản xuất Oxy
– Trong phòng thí nghiệm, oxi được tạo ra bằng cách đun nóng các hợp chất giàu oxi không bền với nhiệt.
– Trong công nghiệp, oxi được tạo ra từ không khí (phân đoạn không khí lỏng) và nước (điện phân nước).
2. phản ứng phân hủy.
Phản ứng phân hủy là phản ứng hóa học trong đó một chất tạo ra hai hay nhiều chất mới.
b. Bài tập 27 SGK Hóa học 8 Trang 94: Phản ứng điều chế-khử oxi
Bài 1 Chất nào sau đây được dùng để điều chế oxi trong phòng thí nghiệm:
a) fe3o4; b) kclo3; c) kmno4; d) caco3; e) không khí; g) nước
Giải: Các chất dùng để điều chế khí oxi trong phòng thí nghiệm: b) kclo3; c) kmno4.
Bài 2 Sự khác biệt giữa sản xuất oxy trong phòng thí nghiệm và sản xuất oxy công nghiệp về nguyên liệu thô, sản lượng và chi phí là gì?
Đáp án bài 2:
Phòng thí nghiệm
Ngành công nghiệp
Thành phần
kmno4, kclo3
Xem Thêm: Suy nghĩ của em về nhân vật Vũ Nương
không khí, nước
Sản xuất
Đủ để thử nghiệm
Đầu ra lớn
Giá
Xem Thêm : Toán lớp 5 trang 19, 20 Luyện tập
Cao
Thấp
bài 3.Sự khác biệt giữa phản ứng phân hủy và phản ứng hóa học là gì? Cho hai ví dụ để minh họa.
Mô tả:
Poster 4 trang 94 Hóa học 8: Tính số gam kali clorat cần dùng để điều chế: a) 48 gam oxi;
b) 44,8 lít oxi (dktc).
Trả lời:
Phương trình phản ứng hóa học:
2kclo3-> 2kcl + 3o2
2mol 3mol
A. Số mol khí oxi tạo thành:
Xem Thêm: Cảm nhận về bài thơ Quê hương của Tế Hanh – Văn mẫu lớp 8
no2 = 48/32 = 1,5 (mol).
Theo phương trình phản ứng hóa học ta có: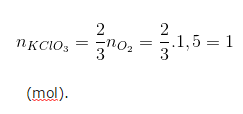
Khối lượng kali clorat cần dùng là:
mkclo3 = n.m = 1.(39 + 35,5 + 48) = 122,5 (g).
b) Số mol oxi tạo thành:
no2 = 44,8/22,4= 2(mol).
Theo phương trình phản ứng hóa học ta có:

Khối lượng kali clorat cần dùng là:
mkclo3 = n.m = 1,333.(39 + 35,5 + 48) = 163,3 (g)
Xem Thêm : Giải bài 1,2,3, 4,5 trang 87 Hóa học 8: Sự oxi hóa – Phản ứng hóa hợp
Bài 5: Nung đá vôi caco3 bằng vôi sống và khí cacbonic ở nhiệt độ cao.
a) Viết phương trình hóa học của phản ứng.
b) Phản ứng nung vôi thuộc loại phản ứng hóa học nào? Tại sao?
Hướng dẫn:
a) caco3 -tº→ cao + co2
b) Phản ứng nung phản ứng phân hủy. Vì dưới tác dụng của nhiệt độ, 1 chất (đá vôi) bị phân hủy thành 2 chất (vôi sống và khí cacbonic).
Xem Thêm: Luyện tập 2: Giải bài 39 40 41 42 trang 124 sgk Toán 7 tập 1
Bài 6 Trong phòng thí nghiệm, người ta dùng O2 oxi hóa sắt ở nhiệt độ cao để điều chế sắt oxit từ Fe3O4.
A. Tính số gam sắt và oxi cần dùng để điều chế 2,32g oxit sắt từ?
Tính lượng oxi cần dùng cho phản ứng trên bằng gam kali pentmanganat kmno4 Biết rằng khi đun nóng 2 mol kmno4 thu được 1 mol oxi.
Giải pháp thay thế:
A. Số mol oxit sắt từ: = 0,01 (mol).
Phương trình hóa học.
3fe + 2o2 -> fe3o4
3mol 2mol 1mol.
0,01 nốt ruồi
Lượng sắt cần thiết là:
Chất lượng oxy cần thiết là:
Phương trình hóa học:
2kmno4-> k2mno4 + o2
2mol 1mol
n = 0,04 0,02
Khối lượng gam penmangarat cần dùng là: m = 0,04. (39 + 55 +64) = 6,32 gam.
Nguồn: https://anhvufood.vn
Danh mục: Giáo Dục





