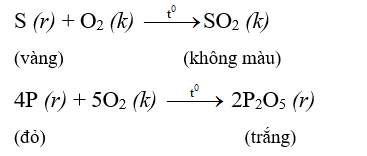Bạn đang đau đầu với khối kiến thức hóa học khổng lồ? Khái niệm, tính chất vật lý, tính chất hóa học và bài tập ứng dụng mở rộng. Hôm nay, hãy để chúng tôi giúp bạn nâng cao kiến thức về các bộ phận phi kim loại – một trong những phần quan trọng nhất.
Bạn Đang Xem: Phi kim là gì? Tính chất hóa học? Các loại phi kìm thường gặp?
1. phi kim là gì?
Phi kim là những nguyên tố ở vế phải của bảng tuần hoàn, thường ở dạng phân tử. Chúng là những nguyên tố hóa học dễ dàng nhận điện tử, ngoại trừ hydro. Đa số phi kim không dẫn điện, một số nguyên tố bị biến tính.
2. Tính chất vật lý:
Ở điều kiện thường, phi kim tồn tại ở 3 trạng thái: thể rắn như lưu huỳnh, cacbon, photpho…; thể lỏng như brom; thể khí như oxi, nitơ, hiđro, clo…
Hầu hết các nguyên tố phi kim đều không dẫn điện, không dẫn nhiệt, nhiệt độ nóng chảy thấp. Một số phi kim có độc tính cao, chẳng hạn như clo, brom và iốt.
3. Tính chất hóa học:
3.1. Hiệu ứng kim loại:
Nhiều phi kim phản ứng với kim loại để tạo thành muối:
3.2. Hiệu ứng hydro:
Oxy phản ứng với hydro
+ Oxy phản ứng với hydro tạo thành hơi nước:
– Clo phản ứng với hydro
+ Hiđro cháy trong clo tạo thành chất khí không màu. Màu vàng lục của khí clo biến mất. Giấy quỳ chuyển sang màu đỏ.
Clo phản ứng mãnh liệt với hiđro tạo thành khí hiđro clorua không màu. Khí này tan trong nước tạo thành axit clohiđric làm quỳ tím chuyển sang màu đỏ.
– Ngoài ra, nhiều phi kim khác như c, s, br2… phản ứng với hiđro tạo thành hợp chất khí.
3.3. Phản ứng với oxi:
Nhiều phi kim phản ứng với oxi tạo thành oxit axit.
4. Các phi kim thông dụng:
Sự tồn tại của phi kim rất đa dạng và phổ biến, các phi kim thường gặp gồm: c, o, h, s, p, n, cl, br, i, f…
5.Ứng dụng của phi kim:
Các nguyên tố phi kim đóng vai trò quan trọng trong các phản ứng tổng hợp với các hợp chất khác để tạo ra sản phẩm.
Oxy: Oxy phục vụ hai mục đích quan trọng trong cuộc sống, thở và đốt cháy nhiên liệu. Oxy rất cần thiết cho sự sống còn của cả con người và động vật. Các thợ lặn, nhà thám hiểm đại dương… khi đi biển phải sử dụng bình dưỡng khí đặc biệt, nhiên liệu đốt cháy trong khí ôxy sẽ sinh ra nhiệt độ cao hơn so với trong không khí. Trong sản xuất thép, oxy được thổi vào lò để tạo ra nhiệt độ cao, giúp nâng cao hiệu quả và chất lượng của thành phẩm.
Nitơ: Nitơ được sử dụng trong bảo quản bao bì thực phẩm, luyện kim, hàn đường ống, bơm lốp ô tô, máy bay…
Clo: dùng để pha chế đường nước, clo hóa vôi, tẩy vải, bột giấy, điều chế nhựa PVC, cao su…
Lưu huỳnh:
Chức năng:
Tham gia vào quá trình hình thành protein, hormone và insulin.
Tẩy trắng, khử chì, thủy ngân.
Khử trùng phòng điều trị bệnh truyền nhiễm.
Tham gia quá trình giải độc và oxy hóa trong cơ thể.
Thực phẩm có hàm lượng lưu huỳnh cao như hải sản, hành, tỏi, dầu thực vật, thịt, trứng, hạt cải dầu…
Ứng dụng:
caso4.h2o dùng làm khuôn
Phèn chua k2so4.al(so4)3.24h2o làm từ nước
(nh4)2s2o8 dùng để tẩy trắng, khử trùng.
Kali Thiosulfate (k2s2o3) hỗ trợ điều trị các bệnh ngoài da.
Hydrogen: Dùng làm mỏ hàn – hàn oxy để cắt kim loại, bơm khinh khí cầu, nhiên liệu cho động cơ tên lửa, động cơ ô tô thay xăng…
Luồng:
Chức năng:
Xem Thêm: Phân tích bài thơ Đất nước đoạn 3
Là vi chất tham gia vào quá trình phát triển răng, tạo ngà và men răng.
Đóng vai trò quan trọng trong quá trình tạo xương và ảnh hưởng đến quá trình điều hòa, chuyển hóa canxi và phốt pho.
Thực phẩm: Chè, bắp cải, xà lách, rau câu, tôm, cua chứa nhiều flo…
Ứng dụng:
naf: Thêm f- vào nước thiếu nguyên tố vi lượng hoặc thêm vào kem đánh răng để ngừa sâu răng..
f còn gắn vào các hợp chất hữu cơ làm tăng tác dụng sinh học.
6. Bài tập thực hành:
Phần 1: Phân biệt phi kim với kim loại:
Kim loại và phi kim khác nhau về tính chất vật lý và hóa học.
Kim loại là chất dẫn điện và dẫn nhiệt tốt, khi bị biến đổi về mặt hóa học, chúng sẽ mất electron và trở thành cation. Ngoài ra, kim loại ở thể rắn ở nhiệt độ phòng, mềm dẻo và co giãn được. Thông thường, chúng có một hoặc hai màu, chủ yếu là màu bạc trong bóng râm.
Mặt khác, phi kim không phải là chất dẫn điện như vậy và khi chúng trải qua những thay đổi hóa học, chúng sẽ nhận được các electron và trở thành anion. Ngoài ra, phi kim có thể ở dạng rắn, lỏng hoặc khí và có nhiều màu sắc khác nhau. Nếu chúng rắn, chúng giòn và không đàn hồi hoặc không linh hoạt.
Từ đó, chúng ta có thể kết luận rằng sự khác biệt cơ bản giữa kim loại và phi kim như sau:
Xem Thêm : Thuyết minh về thành nhà Hồ (Dàn ý 3 mẫu) Những bài văn mẫu lớp 8
– Kim loại dẫn điện và dẫn nhiệt tốt, phi kim dẫn nhiệt kém.
– Kim loại có tính dẻo và dễ uốn, trong khi phi kim nói chung là chất rắn.
– Kim loại thường là chất rắn, trong khi phi kim đa dạng hơn và có thể là chất rắn, chất lỏng hoặc chất khí.
– Kim loại có độ bóng hoặc độ bóng nhất định, trong khi phi kim mất đi độ bóng; tuy nhiên, phi kim có nhiều màu sắc khác nhau.
– Kim loại thường tạo thành oxit bazơ, còn phi kim là chất oxi hóa tốt.
– Kim loại thay đổi electron khi chúng trải qua phản ứng hóa học, trong khi phi kim nhận electron và trở thành anion.
– Phi kim có nhiệt độ nóng chảy và sôi thấp hơn đáng kể so với kim loại,
Ngoại lệ là carbon.
– Phi kim là carbon, hydro, nitơ, phốt pho, oxy, lưu huỳnh, selen, halogen và khí hiếm.
Bài toán 2: Khử hoàn toàn 69,6 g hỗn hợp A gồm FeO, Fe2O3, Fe3O4 và CuO thành kim loại ở nhiệt độ cao cần dùng 24,64 L khí CO và thu được x g chất rắn. Cũng cho 69,6 gam a phản ứng với dung dịch hcl vừa đủ thu được dung dịch b chứa y gam muối. Cho b phản ứng với dung dịch dư tạo z gam kết tủa.
a)Giá trị của x
a. 52,0 gam. b. 34,4g.
c. 42,0 gam. d. 28,8g.
b) Giá trị của y
a. 147,7 gam. b. 130,1 g.
c. 112,5 gam. d. 208,2g.
c) Giá trị của z
a. 70,7 gam. b. 89,4g.
c. 88,3 gam. d. 87.2.g
Mô tả:
a) nco = 24,64/22,4 = 1,1 mol
Ta có: aco + m2oa → 2m + aco2
Cách tăng hoặc giảm âm lượng:
Xem Thêm: Hãy phân tích bài thơ bảo kính cảnh giới 43 của Nguyễn Trãi
1 mol mỗi phản ứng → khối lượng chất rắn là 16 gam
→ Vậy 1,1 mol đồng phản ứng → Khối lượng chất rắn giảm 16.1,1 = 17,6 gam
Khối lượng chất rắn sau phản ứng là: x = 69,6 – 17,6 = 52 gam
→ Trả lời một
b) Theo a) ta được hỗn hợp oxit khử hoàn toàn → no(oxit) = nco phản ứng = 1,1 mol
69,6 gam dung dịch a+hcl (vừa đủ) → dung dịch b chứa y gam muối
m2oa + 2ahcl → 2mcla + xh2o
Cách tăng hoặc giảm âm lượng:
Ta thấy 1 mol o trong oxit bị thay thế bởi 2 mol cl tạo thành muối → khối lượng muối tăng so với khối lượng oxit là: 2,35,5 – 16 = 55 gam
→ 1,1 mol o trong oxit được thay thế bằng 2,2 mol cl → khối lượng muối tăng so với khối lượng oxit là: 1.1,55 = 60,5 gam
→ y = 69,6 + 60,5 = 130,1 gam
→Đáp án b
c) Cho b+ dung dịch dư → z gam kết tủa
mcla + anaoh → m(oh)a + anacl
Cách tăng hoặc giảm âm lượng:
Ta thấy 1 mol cl trong muối bị thay thế bởi 1 mol oh tạo thành hiđroxit → khối lượng hiđroxit giảm so với khối lượng muối là: 35,5 – 17 = 18,5 gam
→ 2,2 mol cl trong muối được thay thế bằng 2,2 mol oh → khối lượng hiđroxit giảm so với khối lượng muối là: 18,5.2,2 = 40,7 gam
→ z = 130,1 – 40,7 = 89,4 gam
→Đáp án b
Bài toán 3: Hấp thụ hoàn toàn 0,16 mol co2 vào 2 lít dd ca(OH)2 0,05M thu được kết tủa x và dd y. Cho biết thể tích dd y tăng hay giảm bao nhiêu so với dd ca(oh)2 ban đầu?
Mô tả:
nca(oh)2 = 0,05.2=0,1 nốt ruồi
t = nco2 : nca(oh)2 = 0.16/0.1 = 1.6 → 1 <; t < 2 → tạo muối caco3 và ca(hco3)2
Xem Thêm : Hướng dẫn Giải bài 1 2 3 4 5 trang 30 31 sgk Hóa học 8
co2 + ca(oh)2 → caco3 + h2o
0.1………….0.1………0.1
→ Số mol CO2 dùng để hòa tan cặn là: 0,16 – 0,1 = 0,06 mol
co2 + caco3 + h2o → ca(hco3)2
0,06 → 0,06
→ Số mol kết tủa còn lại là: 0,1 – 0,06 = 0,04 mol
→ m ↓ = mcaco3 = 0,04.100 = 4g
→ mdd tăng = mco2 – mcaco3 = 0,16,44 – 4 = 3,04g
Bài 4: Một hỗn hợp x gồm feco3 và baco3 được nung trong không khí đến khối lượng không đổi thu được chất rắn y và v lít co2 (dktc). Hòa tan y vào nước dư thu được dung dịch z và 8 gam chất rắn không tan. Hấp thụ hết v lít khí CO2 vào z thu được 9,85 gam kết tủa. Khối lượng của feco3 và baco3 trong hỗn hợp ban đầu?
Mô tả:
4feco3 + o2 −to→ 2fe2o3 + 4co2
Xem Thêm: Viết bản tin ngắn về môi trường lớp 11 – 2 bài mẫu hay nhất
x……………………→ 0,5x……. x
baco3 −to→ bao + co2
Có…………..→..Có…Có
nco2 = x+y
Chất rắn y gồm: fe2o3 và phong bì
y + nước dư: chất rắn không tan là fe2o3
→ 160.0,5x = 8 → x = 0,1 mol → nco2 = 0,1 + y
bao + h2o → ba(oh)2
y.…………..→……..y
Giải pháp z là giải pháp của ba(oh)2
ba(oh)2 + co2 → baco3 + h2o
Bạn… →…là…là
→ Số mol CO2 còn lại để hòa tan kết tủa baco3 là: (0,1+y) – y = 0,1 mol
co2 + baco3 + h2o → ba(hco3)2
0,1……→…..0,1…………………….0.1
nbaco3 = y-0,1 = 9,85/197 = 0,05 mol → y = 0,15 mol
mfeco3 = 0,1116 = 11,6g
mbaco3 = 0,15.197 = 29,77g
Bài toán 5: Nung 10,23 g hỗn hợp hai oxit cuo và pbo với cacbon dư. Toàn bộ khí CO2 sinh ra được dẫn vào bình đựng dung dịch Ca(OH)2 dư. Sau phản ứng thu được 5,5 gam kết tủa. Tính phần trăm khối lượng mỗi oxit kim loại trong hỗn hợp.
Hướng dẫn giải pháp:
Phương trình hóa học:
2cuo + c 2cu + co2 (1)
a → 0,5a nốt ruồi
2pbo + c 2pb + co2 (2)
b 0,5.b nốt ruồi
co2 + ca(oh)2 → caco3 + h2o (3)
– Theo (1), (2) và (3):
nco2 = ncaco3 = = 0,055mol
– Gọi x, y là số mol của cuo và pbo trong 10,23 gam hỗn hợp.
Ta có: 80a + 223b = 10,23
0,5a + 0,5b = 0,05
Giải hệ phương trình trên, ta có: a = 0,1 ; b = 0,01
Thành phần phần trăm khối lượng của các oxit trong hỗn hợp:
%cuo = 78,2%;
% pbo = 21,8%.
Nguồn: https://anhvufood.vn
Danh mục: Giáo Dục
- Nhân tướng học: Đường tài vận nói gì về mức độ thành công trong tương lai của bạn?
- Giải toán lớp 7 SGK tập 2 trang 45, 46 chính xác nhất
- Phân tích cảnh cho chữ trong “Chữ người tử tù” của Nguyễn Tuân
- Tất tần tật về cấu trúc Find: Phân biệt Find và Found
- Chứng nhận Hàng Việt Nam chất lượng cao phù hợp tiêu chuẩn