- Kim loại là nguyên tố dễ bị nhường electron trở thành ion dương
- Phi kim là nguyên tố dễ dàng nhận electron và trở thành ion âm.
-
Kim loại càng bền thì càng dễ bị nhường electron.
Bạn Đang Xem: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và Định
-
Khả năng nhận electron của phi kim càng mạnh.
1.1.1. Thay đổi thuộc tính trong một chu kỳ
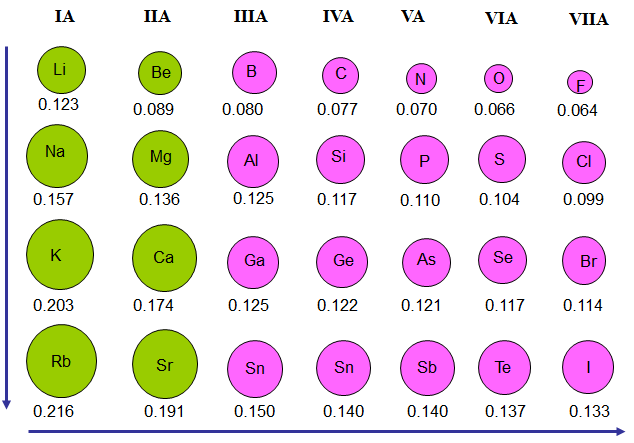
Hình 1:Bán kính nguyên tử của các nguyên tố
Ở mỗi chu kỳ, bán kính nguyên tử giảm dần từ trái sang phải
Trong mỗi nhóm a, bán kính nguyên tử tăng dần từ trên xuống
- Tính kim loại giảm dần, tính phi kim tăng dần.
-
Theo chiều điện tích hạt nhân tăng, điện tích hạt nhân tăng, số lớp vỏ electron không đổi, lực hút giữa hạt nhân và các electron lớp ngoài cùng tăng, bán kính nguyên tử nhỏ dần, độ hụt electron giảm , và khả năng nhận electron tăng lên.
1.1.2. Biến thể của các thuộc tính trong nhóm a
-
Tính kim loại tăng, tính phi kim giảm.
-
Theo chiều tăng điện tích hạt nhân ở nhóm a, số lớp vỏ electron tăng làm bán kính nguyên tử tăng, lực hấp dẫn giữa hạt nhân và electron lớp ngoài cùng giảm, khả năng nhường electron tăng , và tăng khả năng nhận electron. .
-
Theo chiều điện tích hạt nhân tăng dần, tính kim loại của các nguyên tố nhóm a tăng dần, tính phi kim giảm dần.
1.1.3. Độ âm điện
Xem Thêm: Từ vựng HAY cho IELTS Speaking Writing band 8.0 – P1
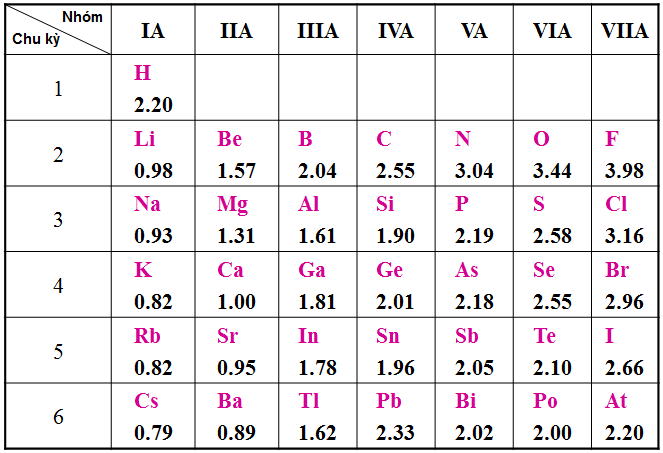
Hình 2: Độ âm điện của một số nguyên tố nhóm a bảng tuần hoàn theo Paulin
-
Nguyên tử có độ âm điện càng lớn thì tính phi kim càng lớn và ngược lại.
-
Trong một khoảng thời gian chiều điện tích hạt nhân tăng dần, độ âm điện tăng dần.
-
Xem Thêm : Tính cân bằng ẩm của một số địa phương nước ta – iDiaLy.com
Khi diện tích hạt nhân tăng thì độ âm điện của nhóm a giảm.
-
Sự biến thiên giá trị độ âm điện tương ứng với tính kim loại và tính phi kim.
-
Độ âm điện của nguyên tố càng lớn thì tính phi kim càng lớn và tính kim loại càng kém và ngược lại.
-
Ở chu kỳ 3, từ trái sang phải, hóa trị cao nhất của nguyên tố oxi tăng dần từ 1 đến 7, còn hóa trị của hiđro trong hợp chất khí giảm dần từ 4 xuống 1
-
Trong chu kỳ hóa trị cao nhất của một nguyên tố, oxi tăng và hiđro giảm.
Natri
r2o
Tôi đi đây
Xem Thêm: Bài 3: Con lắc đơn
Ro
Nhôm
r2o3
Silicon điôxit
ro2
p2o5
r2o5
Xem Thêm : Đánh Giá Trường THPT Chuyên Phan Bội Châu – Thành phố Vinh Nghệ An Có Tốt Không?
Vậy 3
ro3
cl2o7
r2o7
Xem Thêm: 8 cách điều trị đục dịch kính hay ruồi bay trước mắt
sih4
rh4
ph3
rh3
h2s
r2s
axit clohydric
Xin chào
Oxit và hiđroxit ít bazơ hơn và axit hơn.
na2o + h2o → 2naoh
cl2o7 + h2o \(\leftrightarrows\) 2hclo4
Các nguyên tố và tính chất của chúng, cũng như thành phần và tính chất của các hợp chất bao gồm các nguyên tố này, thay đổi tuần hoàn theo hướng tăng điện tích cho hạt nhân.
-
-
-
Nguồn: https://anhvufood.vn
Danh mục: Giáo Dục