Có thể bạn quan tâm
Axit là gì? Axit hóa học và
Bạn Đang Xem: AXIT LÀ GÌ? TÍNH CHẤT HÓA HỌC CỦA AXIT VÀ MỘT SỐ ỨNG
Một số ứng dụng trong cuộc sống
Axit là gì? Có những loại axit nào? Làm thế nào để đánh giá sức mạnh của axit? Tính chất hóa học của axit? Axit tốt để làm gì? Đây có thể là một vấn đề đối với nhiều bạn. Hôm nay, Môi trường báo cáo sẽ giúp bạn trả lời những câu hỏi này thông qua nội dung của các bài viết sau. Theo chúng tôi!
Axit là gì?
Axit là hợp chất có công thức hxa, có vị chua, tan trong nước tạo thành dung dịch có nồng độ ph < . 7. Giá trị pH càng cao thì tính axit càng yếu và ngược lại.
Ngoài ra, còn có một cách định nghĩa khác về axit như sau “Axit là phân tử hoặc ion có khả năng nhường proton h+ cho bazơ hoặc nhận cặp electron chưa phân li từ bazơ”.
Có những loại axit nào?
Hóa học dựa trên axit
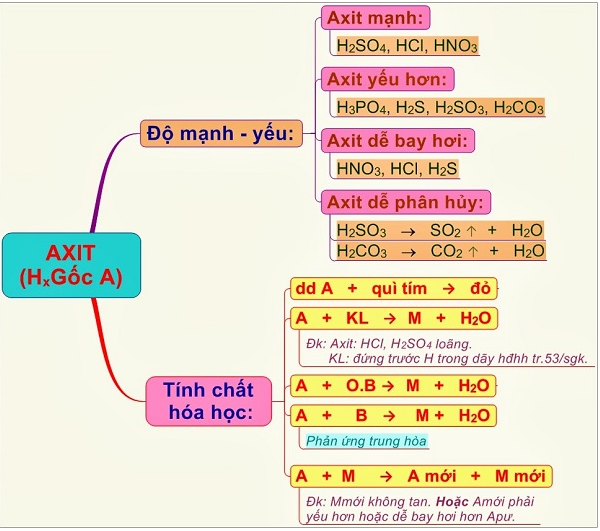
– Axit mạnh: axit clohydric hcl, axit sunfuric h2so4, axit nitric hno3, …
– Axit yếu: hiđro sunfua h2s, axit cacbonic h2co3, …
Dựa trên nguyên tử oxy
– Axit kỵ khí: hcl, h2s, hbr, hi, hf…
– Axit có oxi: h2so4, hno3, h3po4, h2co3…
Ngoài ra, ta còn có thể chia axit thành các dạng sau:
– Axit vô cơ: hcl, h2so4, hno3, …
– Axit hữu cơ – rcooh: ch3cooh, hcooh,…
Tổng quan về axit
Cách đánh giá độ mạnh của axit
Xem Thêm: Khu Du Lịch trong Tiếng Anh là gì: Định Nghĩa, Ví Dụ Anh Việt
– Phụ thuộc vào độ linh động của nguyên tử hiđro trong axit. H càng lỏng thì tính axit càng mạnh và ngược lại.
– Đối với axit chứa cùng một nguyên tố có oxi, càng ít oxi thì axit càng yếu
hiđro clorua> hclo3> hclo2>hiđro clorua
– Axit của các nguyên tố cùng chu kỳ, khi nguyên tố đó ở hóa trị cao nhất thì tính phi kim của nguyên tố trung tâm càng yếu thì axit càng yếu.
Hydro clorua> h2so4> h3po4
-Axit có cùng nguyên tố a
Xem Thêm : Soạn bài Bài tập làm văn | Hay nhất Soạn văn 6 Kết nối tri thức
+ Axit oxi: tính axit tăng dần từ dưới lên trên: hio4 <; hbro4<hiđro clorua
+ Axit yếm khí: tính axit giảm dần từ dưới lên trên: hi >; hbr>axit clohydric>cao
– với axit hữu cơ rcooh
+ Tính axit giảm nếu r đẩy electron (gốc r bão hòa)
Choooh>ch3cooh>ch3ch2cooh>ch3ch2ch2cooh>n-c4h9cooh.
+ Nếu r hút e (r nhóm không no, thơm hoặc có nguyên tố halogen,…) thì tính axit mạnh
Tính chất của axit
1. Thuộc tính vật lý
– tan trong nước, chua
– Đau dữ dội khi tiếp xúc với axit mạnh
-Là chất điện phân nên dẫn điện
2. Tính chất hóa học của axit
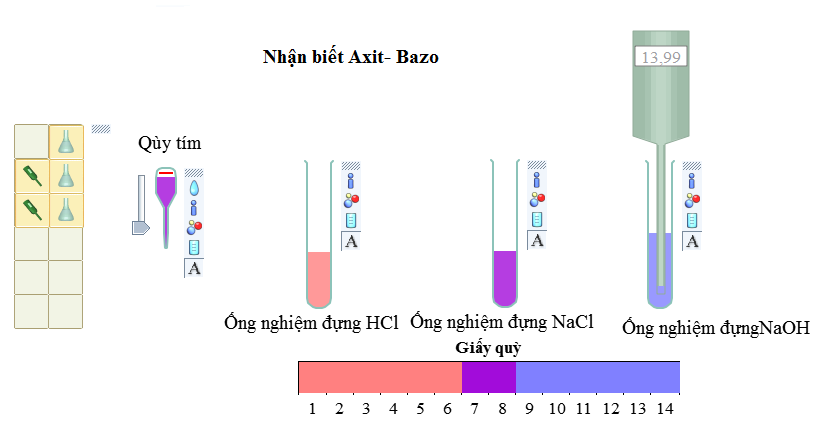
– Sự đổi màu của chất chỉ thị (giấy quỳ xanh, giấy pH, dung dịch phenolphtalein).
Xem Thêm: Các Công Thức Lượng Giác Toán 10 Đầy Đủ Nhất
Axit làm đổi màu quỳ tím
– Phản ứng với một số kim loại để tạo thành muối và giải phóng khí hydro. Đối với axit sunfuric và axit nitric đặc nóng, nó có thể phản ứng với hầu hết các kim loại để tạo ra khí lưu huỳnh đioxit so2 (h2so4) hoặc nitơ đioxit no2 (hno3)
axit clohydric + sắt-> fecl2 + h2
2fe + 6h2so4 -> fe2(so4)3 + 6h2o + 3so2
– Phản ứng với bazơ tạo thành muối và nước
cu(oh)2 + h2so4 -> cuso4 + 2h2o
– Phản ứng với oxit bazơ tạo thành muối+nước
na2o + 2hcl → 2nacl + h2
feo + h2so4(loãng hơn) → feso4 + h2o
cuo + 2hcl → cucl2 + h2o
– Phản ứng với muối tạo thành muối mới và axit mới
Điều kiện phản ứng
+ Muối hoạt tính là muối tan
Xem Thêm : Giải thích câu tục ngữ Một con ngựa đau cả tàu bỏ cỏ
+ Muối mới không tan trong axit mới
+ Sản phẩm có chứa cặn hoặc chất bay hơi
h2so4 + bacl2 → baso4(r) + 2hcl
k2co3 + 2hcl → 2kcl + h2o + co2 (axit cacbonic phân hủy thành nước và khí cacbonic)
Một số ứng dụng của axit trong đời sống
– Loại bỏ rỉ sét và các chất ăn mòn khác khỏi kim loại
Xem Thêm: Shut Down là gì và cấu trúc cụm từ Shut Down trong câu Tiếng Anh
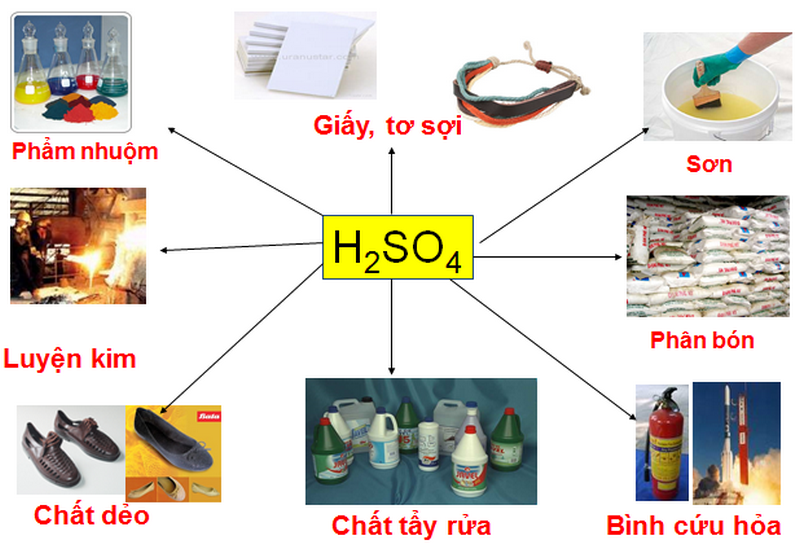
– Axit sunfuric được dùng làm chất điện phân trong ắc quy ô tô
Ứng dụng của axit sunfuric
– Axit mạnh được sử dụng rộng rãi trong ngành chế biến khoáng sản
– Trong khai thác dầu, axit clohydric được bơm vào thành tạo giếng để hòa tan một phần đá, còn được gọi là “rửa trôi giếng”, tạo ra các lỗ rỗng lớn hơn. >
– Pha axit clohydric đậm đặc và axit nitric theo tỷ lệ 3:1 để hòa tan vàng và bạch kim
– Dùng làm phụ gia chế biến, bảo quản đồ uống, thực phẩm
– Axit nitric phản ứng với amoniac để tạo ra phân amoni nitrat, một loại phân bón.
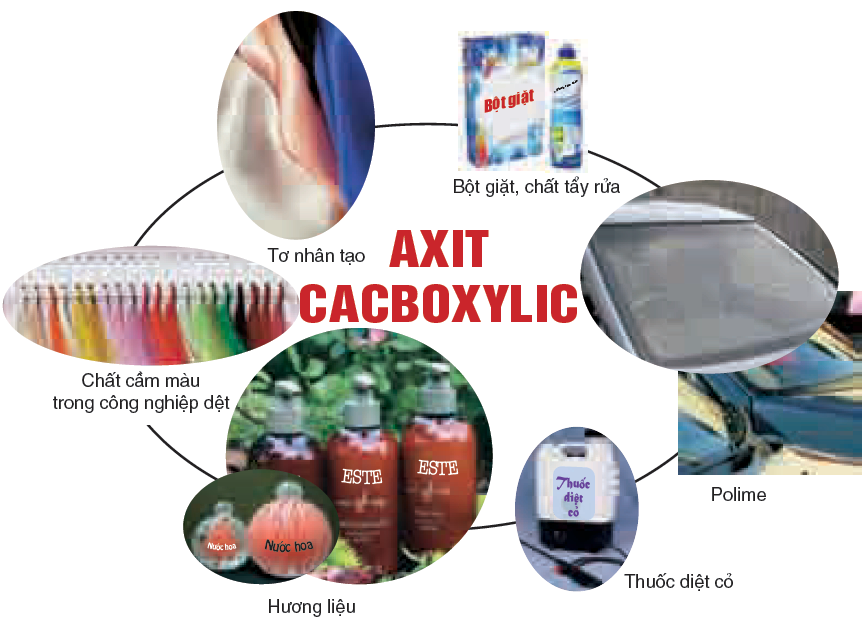
– Axit cacboxylic có thể este hóa với ancol tạo thành este.
Ứng dụng của axit cacbonic
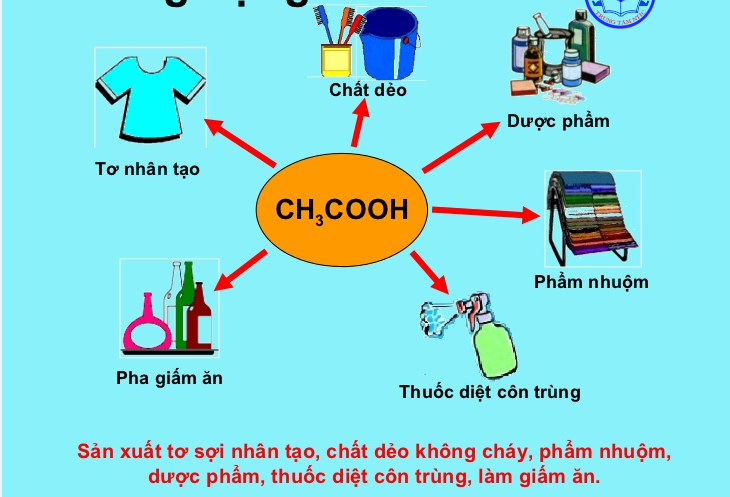
Một số ứng dụng của axit axetic
– Trong y học
+ Axit acetylsalicylic (aspirin) làm thuốc giảm đau và hạ sốt
+ Axit boric được dùng làm chất khử trùng cho các vết bỏng hoặc vết cắt nhỏ. Khi pha loãng, nó trở thành thuốc rửa mắt. Đồng thời, nó còn là chất kháng khuẩn, được dùng để trị mụn trứng cá, nấm da chân, dùng làm chất bảo quản mẫu nước tiểu trong các thí nghiệm.
– Axit clohydric trong dạ dày giúp cơ thể tiêu hóa thức ăn
– Axit amin được sử dụng để tổng hợp protein cần thiết cho sự phát triển của sinh vật và sửa chữa các mô cơ thể.
– Axit nuclêic cần thiết cho quá trình tạo ra dn, arn và truyền các tính trạng cho đời con thông qua gen.
– Axit cacbonic cần thiết để duy trì sự cân bằng ph trong cơ thể
Trên đây là những chia sẻ của Công ty TNHH Giải pháp Công nghệ Môi trường Phước Trình về axit là gì? Tính chất hóa học của axit và một số ứng dụng trong thực tế. Hy vọng các bạn đã có thêm những thông tin hữu ích cho mình. Hiện nay, Môi trường Phước Trình đang có sẵn nhiều loại axit chất lượng như axit clohydric, axit sulfuric,…Nếu bạn nào có nhu cầu tìm mua, vui lòng liên hệ trực tiếp đến số HOTLINE 0972.662.725 để được tư vấn tốt nhất. 
Nguồn: https://anhvufood.vn
Danh mục: Giáo Dục
- Tài sản thương hiệu là gì? Tại sao phải bảo vệ tài sản thương hiệu ngay trong mùa dịch?
- Bài 1,2,3, 4,5,6 trang 94 SGK Hóa 8: Điều chế khí oxi
- Code Treasure Hunt Simulator 2022, Cách nhập chính xác
- Cách làm thạch dưa hấu ngon mát – đỏ tươi nhìn đã mê, ăn càng phê
- So Sánh Hình Ảnh Người Lính Trong Kháng Chiến Chống Mỹ, Pin




