Có thể bạn quan tâm
- Giải bài 83, 84, 85, 86 trang 109 sgk toán 8 tập 1
- Giải bài 1: Trung thực trong học tập – Đạo đức 4, trang 3 sgk
- Kịch bản chương trình Tết Trung thu 2022 9 mẫu kịch bản tổ chức chương trình Trung thu hay nhất
- Soạn bài Việt Bắc – Phần 1: Tác giả | Ngắn nhất Soạn văn 12
- Kể chuyện: Nhà vô địch trang 139 SGK Tiếng Việt 5 tập 2
Hướng dẫn giải 30. Lưu huỳnh SGK Hóa học 10. Nội dung khóa học 1 2 3 4 5 Trang 132 SGK Hóa học 10 bao gồm đầy đủ lý thuyết và bài tập, công thức, phương trình hóa học, chuyên đề…tất cả đều có trong bộ sách giáo khoa Trung-Israel giúp học sinh vượt qua môn Hóa 10 và chuẩn bị cho kỳ thi tốt nghiệp THPT quốc gia.
Bạn Đang Xem: Giải bài 1 2 3 4 5 trang 132 sgk Hóa Học 10
Lý thuyết
i – vị trí, cấu hình electron của nguyên tử
Vị trí của phần tử s: z = 16; chu kỳ 3; nhóm en.
Cấu hình e: 1s22s22p63s23p4
ii – Thuộc tính vật lý
1.Hai đồng vị của lưu huỳnh
– Lưu huỳnh tồn tại ở 2 dạng thù hình: lưu huỳnh sáu phương (sα) và lưu huỳnh đơn tà (sβ).
– Chúng khác nhau về cấu trúc tinh thể và một số tính chất vật lý, nhưng giống nhau về mặt hóa học.
– Chúng thay đổi lẫn nhau theo nhiệt độ.
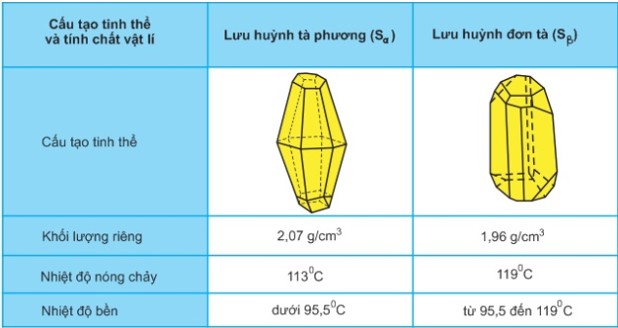
2.Ảnh hưởng của nhiệt độ đến cấu tạo phân tử và tính chất vật lý của lưu huỳnh
-to <;113oc, sα và sβ là chất rắn, màu vàng. Là phân tử gồm 8 nguyên tử liên kết cộng hóa trị với nhau tạo thành vòng.
-to = 119oc,s tan thành chất lỏng màu vàng. vòng lặp s8.
-to = 187oc,s lỏng → nhớt màu nâu đỏ.
– to = 445oc,s sôi → sn phân hủy thành nhiều phân tử nhỏ dễ bay hơi.
Ở 1700oc, hơi lưu huỳnh là s.
iii – Tính chất hóa học của Lưu huỳnh
1. Phản ứng với kim loại và hydro
Lưu huỳnh thể hiện tính oxi hóa khi tác dụng với kim loại và hiđro.
– Hiệu ứng hydro:
h2 + s → h2s (350oc)
– Phản ứng với kim loại (sản phẩm có số oxi hóa kim loại lớn hơn).
\(fe + s \xrightarrow{t{}^{o}} fes\)
\(zn + s \xrightarrow{t{}^{o}} zns\)
\(hg + s → hgs\)
(Quá trình thủy phân sunfua xảy ra ở nhiệt độ thường nên s thường được dùng để khử độc hg)
Chú ý: Một số muối sunfua có màu đặc trưng: cus, pbs, ag2s (đen); mns (hồng); cds (vàng) → thường dùng để nhận biết các gốc sunfua.
– Có 3 loại muối sunfua:
+ Loại 1 tan trong nước gồm na2s, k2s, cas và bas, (nh4)2s.
+ Loại 2. Không tan trong nước, nhưng tan trong axit mạnh, bao gồm fes, zns,…
Xem Thêm: Soạn bài Luyện nói: văn biểu cảm về sự vật, con người – VietJack.com
+ Loại 3. Không tan trong nước, không tan trong axit kể cả cus, pbs, hgs, ag2s,…
2. Phản ứng với phi kim và hợp chất
s thể hiện tính khử khi phản ứng với một số phi kim và một số hợp chất có tính oxi hóa.
– Phản ứng với oxi:
\(s + o_2 \xrightarrow{t{}^{o}} so_2\)
\(s + 3f_2 \xrightarrow{t{}^{o}} sf_6\)
– Tương tác với chất oxy hóa mạnh:
\(s + 2h_2so_4 đặc biệt \xrightarrow{t{}^{o}} 3so_2 + h_2o\)
\(s + 4hno_3 đặc biệt \xrightarrow{t{}^{o}} s_2 + 4no_2 + 2h_2o\)
iv – Ứng dụng
Xem Thêm : Dùi đục chấm mắm cáy là gì? – Từ điển Thành ngữ Tiếng Việt
s là nguyên liệu quan trọng cho nhiều ngành công nghiệp.
– điều chế h2so4
– Dùng để lưu hóa cao su, làm diêm, sản xuất thuốc tẩy bột giấy, chất dẻo cao su cứng, thuốc, thuốc nhuộm, thuốc trừ sâu, thuốc diệt nấm…
v – Sản xuất
1. Khai thác lưu huỳnh
Sử dụng phương pháp frasch để khai thác các s tự do dưới lòng đất.
2.Tạo lưu huỳnh từ các hợp chất
– Đốt cháy hydro trong điều kiện không có không khí.
2h2s + o2 → 2s + 2h2o
– Dùng h2s để loại bỏ so2.
2h2s + so2 → 3s + 2h2o
Phương pháp này giúp thu hồi hơn 90% lượng S trong các khí độc SO2 và H2S.
Bài tập
Dưới đây là hướng dẫn Giải bài 132 SGK Hóa 10 trang 1 2 3 4 5 đầy đủ và ngắn gọn nhất. Chi tiết các bài tập có thể xem bên dưới:
1. Giải bài tập 1 tr.132 Hóa học 10
Phản ứng của lưu huỳnh với axit sunfuric đặc nóng:
s + 2h2so4 → 3so2 + 2h2o
Trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị oxi hóa là
A. 1:2.
1:3.
3:1.
2 : 1.
Giải pháp:
Xem Thêm: Các số oxi hoá có thể có của photpho là : –3 ; +3 ; +5
s là chất khử ⇒ số nguyên tử bị oxi hóa là 1.
h2so4 là chất oxi hóa ⇒ số nguyên tử s bị khử là 2.
Vậy số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị oxi hóa là 2:1.
⇒ Trả lời: d.
2. Giải bài 2 tr.132 Hóa học 10
Chất nào sau đây vừa là chất oxi hóa, vừa là chất khử?
A. cl2, o3, s.
s, cl2, br2.
na, f2, s.
br2, o2, ca.
Giải pháp:
A. \(o_3\) chỉ oxy hóa các loại \( \to\)
nôm na là sự khử, \(f_2\) chỉ là sự oxi hóa\( \to\)
\(o_2\) chỉ là oxi hóa, ca chỉ là khử \( \to\) loại
⇒ Trả lời: b.
3. Giải bài 3 tr.132 Hóa học 10
Làm thế nào để dự đoán sự thay đổi khối lượng riêng và nhiệt độ nóng chảy của lưu huỳnh đơn tà (\(s_{\beta }\)) khi được bảo quản lâu dài ở nhiệt độ phòng?
Giải pháp:
Vì lưu huỳnh (sα) ổn định ở nhiệt độ dưới 95,5 \(^oc\) và lưu huỳnh đơn tà (sβ) nên ở nhiệt độ phòng ta có sự chuyển đổi sau: \({ s_\beta } to {s_\alpha}\)
Vì vậy, khi để lưu huỳnh đơn tà (sβ) ở nhiệt độ phòng trong thời gian dài:
– Khối lượng riêng của lưu huỳnh tăng dần.
– Điểm nóng chảy hạ thấp.
4. Giải bài 4 tr.132 Hóa học 10
Xem Thêm : Kể chuyện: Khát vọng sống trang 136 SGK Tiếng Việt tập 2
Nung nóng hỗn hợp gồm 0,650 gam bột kẽm và 0,224 gam bột lưu huỳnh trong ống nghiệm kín không có không khí. Sau phản ứng thu được chất gì trong ống nghiệm? khối lượng là gì?
Giải pháp:
Ta có:
nzn = \(\dfrac{0,65}{65}=0,01\) nốt ruồi,
ns = \(\dfrac{0,224}{32}=0,007\)mol.
\( \to\) đủ, zn thừa.
Phương trình hóa học của phản ứng:
zn + s → zns
bĐ: 0,01 0,007 (mol)
p>: 0,007 0,007 → 0,007 (mol)
Sau: 0,003 0,007 (mol)
Xem Thêm: Lực là gì vật lý 6? Công thức tính lực?
Khối lượng của các chất phản ứng sau:
mzn(dư) = 0,003,65 = 0,195 g
mzns = 0,007,97 = 0,679g.
5. Giải bài 5 tr.132 Hóa học 10
1,10g hỗn hợp bột sắt-nhôm và 1,28g bột lưu huỳnh vừa đủ.
a) Viết phương trình hóa học của phản ứng xảy ra.
b) Tính phần trăm sắt và nhôm trong hỗn hợp ban đầu theo số lượng và khối lượng các chất.
Giải pháp:
a)Phương trình hóa học của phản ứng.
fe + s \(\xrightarrow{{{t^o}}}\) fes
x nốt ruồi x nốt ruồi
2al + 3s \(\xrightarrow{{{t^o}}}\) al2s3.
y nốt ruồi 1,5y nốt ruồi
b) Ta có \(n_{s}=\dfrac{1,28}{32}=0,04\) (mol).
Gọi số mol của fe và al lần lượt là x và y
Theo phương trình (1):
\({n_{s(1)}} = {n_{f{\rm{e}}}} = x\,\,mol\)
Theo phương trình (2):
\({n_{s(2)}} = \dfrac{3}{2}{n_{al}} = \dfrac{3}{2}y\,\,mol )
\( \to {n_s} = x + \dfrac{3}{2}y = 0,04(*)\)
Trộn = mfe + mal = 56x + 27y = 1,1 (**)
Từ (*) và (**) ta có hệ phương trình:
\(\begin{gathered} \left\{ {\begin{array}{*{20}{c}} {56x + 27y = 1,1}&{} \ {x + 1,5y = 0,04}&{} \end{array} \to \left\{ \begin{gathered} x = 0,01 \hfill \\ y = 0,02 \hfill \\ \end{gathered} \right.} \right \hfill \\ \to \left\{ \begin{gathered} m_{fe} = 0,01,56 = 0,56 (g) \hfill \ m_{al} = 0,02.27 = 0,54(g) \hfill \\ \end{thu thập} \ đúng. \hfill \\ \end{ Thu thập} \)
– Theo khối lượng chất:
\(\left\{ \begin{gathered} \% {m_{fe}} = \frac{{0,56}}{{1,1}}.100\% = 50,9 \% \hfill \\ \% {m_{al}} = 100\% – 50,9\% = 49,1\% \hfill \\ end{gathered} \right . \)
– Theo lượng chất:
\(\left\{ \begin{gathered} \% {n_{fe}} = \frac{{0,01}}{{0,01 + 0,02}}. 100\% = 33,33 \% \hfill \\ \% {n_{al}} = \frac{{0,02}}{{0,01 + 0,02}}. 100\% = 66,67\% \hfill \ \ \end{thu thập} \yes.\)
Trước:
- Giải bài 1 2 3 4 5 6 Trang 127 128 SGK Hóa học 10
- Bài 31. Bài tập số 4. Tính chất của Oxy, Hóa học của Lưu huỳnh 10
- Học Toán 10
- Học Vật Lý 10
- Học Hóa 10
- Học Sinh 10
- Học tốt ngữ văn 10
- Tìm hiểu Lịch sử 10
- Học tốt Địa lý 10
- Học tốt tiếng Anh 10
- Học Tiếng Anh 10 (Sách dành cho học sinh)
- Học Tin học 10
- Học tốt gdcd 10
Tiếp theo:
Xem thêm:
Trên đây là toàn bộ tài liệu hướng dẫn giải bài 132 SGK Hóa học 10 trang 1 2 3 4 5 ngắn gọn và dễ hiểu. Chúc các bạn học tốt môn hóa lớp 10!
“Bài tập nào khó, đã có giabaisgk.com”
Nguồn: https://anhvufood.vn
Danh mục: Giáo Dục
- Soạn bài Ôn tập văn biểu cảm | Soạn văn 7 hay nhất – VietJack.com
- Bước phát triển mới của thủ công nghiệp thời Lý là gì ?
- Cách Nấu Chè Bắp Ngon Thơm Ngọt, Dẻo Mềm | Dạy Pha Chế Á Âu
- Cách nấu canh chua cá lóc chuẩn công thức mẹ nấu, ngon ngất ngây
- Cách vẽ conan đơn giản dễ nhất [Mẫu hình vẽ conan chibi đẹp nhất]




