Có thể bạn quan tâm
- 15 câu Trắc nghiệm Lịch sử 6 Bài 6 (Cánh diều) có đáp án: Ai Cập
- Giải Vật Lí 10 Kết nối tri thức Bài 5: Tốc độ và vận tốc
- Trọn bộ 333 Hình ảnh hoa sinh nhật đẹp tuyệt vời thay cho lời chúc
- Hỏi khó: Số 0 là chẵn hay lẻ – tưởng đơn giản mà chẳng ai dám chắc chắn câu trả lời
- Các biện pháp an toàn khi sử dụng điện
chất điện phân là gì? chất điện giải là gì? Làm thế nào để phân biệt chất điện li mạnh và yếu? Hãy cùng con khỉ tìm hiểu chi tiết lý thuyết và làm một số bài tập về sự điện phân nhé.
Bạn Đang Xem: Sự điện li là gì? Lý thuyết và giải bài tập chi tiết
Khái niệm điện phân là gì? chất điện giải là gì?
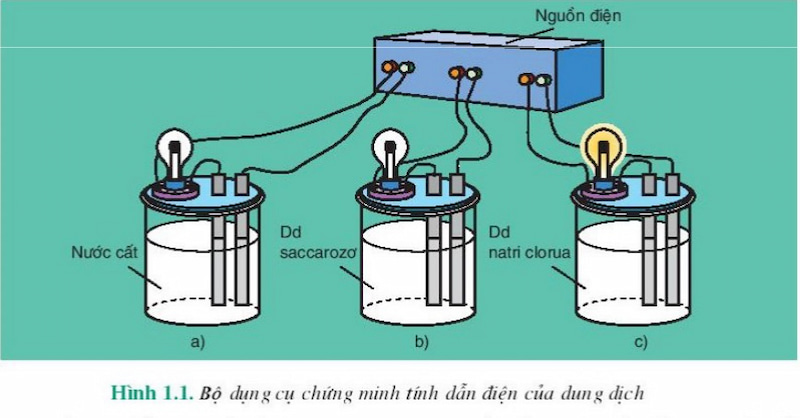
Điện phân (ion hóa) là quá trình phân ly các chất trong nước để tạo thành ion âm (anion) và ion dương (cation). Đây là nguyên nhân làm cho dung dịch axit, bazơ hoặc muối dẫn điện.
Cụ thể hơn, đây là quá trình trong đó các nguyên tử hoặc phân tử thu được điện tích âm hoặc dương bằng cách nhận hoặc mất electron để tạo thành ion. Quá trình này thường đi kèm với nhiều biến đổi hóa học khác.
-
Các ion dương hình thành khi chúng hấp thụ đủ năng lượng (lớn hơn hoặc bằng thế năng tương tác của các electron trong nguyên tử) để giải phóng các electron (còn gọi là các electron tự do). Sự ion hóa Năng lượng là năng lượng cần thiết để quá trình xảy ra.
-
Các ion âm Được hình thành khi các electron tự do va chạm với các nguyên tử mang điện tích trung tính, chúng ngay lập tức bị giữ lại và tạo ra một rào cản tiềm năng với các nguyên tử. Lý do là nó không đủ năng lượng thoát ra khỏi nguyên tử này để tạo thành ion âm.
Chất điện phân đơn giản là chất có liên kết cộng hóa trị có cực hoặc ion phân tách thành các ion riêng lẻ trong môi trường nước (thường là natri clorua).
Electrolyte (chất điện phân, chất điện giải): Một chất hòa tan trong nước (hoặc nóng chảy) rồi phân ly thành ion. Chúng bao gồm: axit, bazơ và muối.
Các chất điện phân được biểu diễn bằng phương trình điện phân.
Ví dụ:
nacl → na+ + cl-
naoh → na+ + oh-
hcl → h+ + cl-
Lý do dung dịch axit, kiềm, muối dẫn điện
Từ các thí nghiệm năm 1887, arenius kết luận rằng dung dịch axit, bazơ và muối dẫn điện vì chúng chứa các hạt trong dung dịch của chúng. Hạt tải điện chuyển động tự do hay còn gọi là ion (gồm anion và cation).
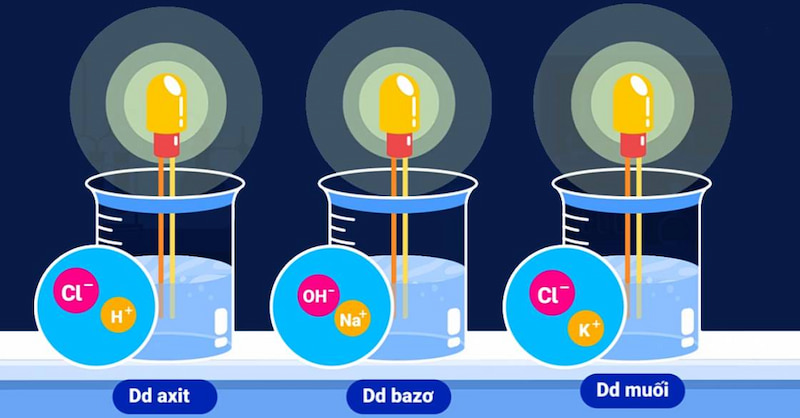
Cụ thể, các phân tử nước được phân cực dương và âm vì các nguyên tử oxy có độ âm điện lớn hơn các nguyên tử hydro. Do đó, cặp electron dùng chung bị lệch về phía oxy. Do đó, khi các chất có liên kết ion hoặc liên kết cộng hóa trị phân cực được hòa tan trong nước, các phân tử của chúng được bao quanh và tương tác với các phân tử nước, phân tách các chất này thành ion, tức là ion dương. (-) được ngăn cách bởi các nguyên tử oxy (tích điện âm) và các ion âm (-) được ngăn cách bởi các nguyên tử hydro (tích điện dương). Liên kết giữa các nguyên tử bị phá vỡ, do đó quá trình giải phóng năng lượng.
Đồng thời, các dung dịch như glycerin, sucrose và ethanol không thể dẫn điện vì chúng sẽ không phân ly thành các ion âm và dương trong dung dịch. Nguyên nhân là do phân tử có liên kết phân cực nhưng rất yếu.
Phân loại chất điện giải
Để phân loại các chất điện li người ta tiến hành các thí nghiệm sau. Chuẩn bị 2 cốc: hcl 0.10m và ch3cooh 0.10m, lắp vào dụng cụ như hình. Khi cùng nguồn đó dẫn đến một đầu dây dẫn thì bóng đèn bên dung dịch HCl sáng hơn bóng đèn bên dung dịch ch3cooh. Từ đó có thể kết luận nồng độ ion trong hcl lớn hơn trong ch3cooh, tức là số lượng ion phân ly ra khỏi hcl nhiều hơn.
Dựa trên thí nghiệm này, chất điện phân được chia thành hai loại: chất điện ly mạnh và chất điện ly yếu.

Chất điện ly mạnh
Khái niệm: Chất điện li mạnh là chất khi tan trong nước thì phân li các phân tử thành ion.
Ví dụ về chất điện ly mạnh:
-
Xem Thêm: Soạn bài Sự phát triển của từ vựng – Lớp 9
axit hcl, hno3, h2so4,…
-
Bazo mạnh như naoh, koh, ba(oh)2 ca(oh)2,…
-
Muối của hầu hết các axit, bazơ mạnh như nacl, kno3, kci, k2so4…
Trong phương trình điện ly của chất điện ly mạnh, Dùng mũi tên một chiều để chỉ chiều của quá trình điện phân.
Ví dụ về phương trình điện phân:
-
nacl là chất điện ly mạnh, nếu cho 100 phân tử nacl hòa tan vào một dung dịch thì cả 100 phân tử đó sẽ phân ly thành ion. nacl → na+ + cl-
-
Xem Thêm : Hay là mở lại khối E?
Trong dung dịch Na2SO4 0,1 M, do Na2SO4 phân ly hoàn toàn nên nồng độ ion phân ly của Na2SO4 tương ứng là 0,2 M và 0,1 M. Phương trình phân ly: na2so4 → 2na+ +s04(2-)
Chất điện li yếu
Khái niệm: Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử trong chất tan đó phân li thành ion, phần còn lại ở dạng phân tử trong dung dịch.
Ví dụ về chất điện li yếu:
-
Các axit yếu như axit hữu cơ ch3cooh, axit clohidric, h2s, he, hcn h2so3,…
-
Các bazơ yếu như bi(oh)3, mg(oh)2, …
Trong phương trình điện phân của chất điện li yếu, hãy sử dụng mũi tên hai đầu.
Ví dụ về phương trình điện phân:
ch3cooh ch3coo- + h+
mg(oh)2 mg2+ + 2oh-
Sự điện li của các chất điện li yếu là quá trình thuận nghịch. Cân bằng điện li được thiết lập khi tốc độ phân ly của các ion bằng tốc độ liên kết của các ion trong phân tử. Đây là những cân bằng động có hằng số cân bằng k, và giống như mọi cân bằng khác, chúng tuân theo nguyên tắc chuyển động của cân bằng vệ tinh lg.
Việc pha loãng ảnh hưởng đến quá trình điện phân như thế nào? Khi pha loãng dung dịch, các ion (+) và (-) của chất điện ly di chuyển ra xa nhau và ít có khả năng va chạm để tái tạo các phân tử, dẫn đến khả năng điện ly tăng.
Xem thêm:Phản ứng trao đổi ion: điều kiện phản ứng và phương trình ion thu gọn
Bài tập sự điện li và đáp án chi tiết SGK Hóa học 11
Nhằm giúp bạn đọc nắm chắc kiến thức về sự điện phân, dưới đây là một số bài tập cơ bản SGK Hóa học 11 có lời giải chi tiết.

Giải bài 1 Trang 7 SGK 11
Dung dịch axit như hcl, bazơ như naoh và muối như nacl có thể dẫn điện, nhưng các dung dịch như etanol, sucrose và glycerin thì không?
Xem Thêm: Soạn bài Xây dựng đoạn văn trong văn bản ngắn nhất
Giải pháp thay thế:
Xem Thêm: Văn mẫu lớp 9: Phân tích nhân vật cô kĩ sư trong Lặng lẽ Sa Pa Dàn ý & 2 bài văn mẫu lớp 9 hay nhất
Trong dung dịch: Axit, bazơ, muối phân li thành các ion dương và ion âm chuyển động tự do nên dung dịch dẫn điện.
Ví dụ:
hcl → h+ + cl-
naoh → na+ + oh-
nacl → na+ + cl-
Các dung dịch như ethanol, sucrose, glycerol, v.v. không dẫn điện vì chúng không phân ly thành các ion dương và âm trong dung dịch.
Giải bài 2 Trang 11, 7
Chất điện phân, chất điện phân là gì? Chất nào là chất điện li? Thế nào là chất điện li mạnh và yếu? Cho ví dụ và viết phương trình điện li của chúng?
Xem Thêm: Soạn bài Xây dựng đoạn văn trong văn bản ngắn nhất
Giải pháp thay thế:
Sự điện phân là sự phân ly các phân tử chất điện phân thành cation (ion dương) và anion (ion âm) khi hòa tan trong nước.
-
Chất điện li là chất khi tan trong nước tạo thành dung dịch dẫn điện.
-
Các chất hoạt động như chất điện giải, chẳng hạn như axit, bazơ và muối hòa tan trong nước.
-
Chất điện li mạnh là chất khi tan trong nước thì phân li thành ion.
Ví dụ:
Xem Thêm : Nghị luận Tuổi trẻ là đặc ân vô giá của tạo hóa ban cho bạn
h2so4 → 2h+ + so4(2-)
koh → k+ + oh-
na2so4 → 2na+ + so42-
Chất điện li yếu là những chất khi tan trong nước chỉ có một số phân tử phân li thành ion, phần còn lại ở dạng phân tử trong dung dịch.
Ví dụ: h2s h+ + hs-
Sách giáo khoa Hóa học Trang 7 Lời giải 3
Viết phương trình điện li của các chất sau:
A. Chất điện li mạnh: ba(no3)2 0,10 m; hno3 0,020 m; 0,010 m Tính nồng độ mol của mỗi ion trong dung dịch.
Chất điện li yếu hiđro clorua; hno2.
Xem Thêm: Soạn bài Xây dựng đoạn văn trong văn bản ngắn nhất
Giải pháp thay thế:
A. Chất điện ly mạnh:
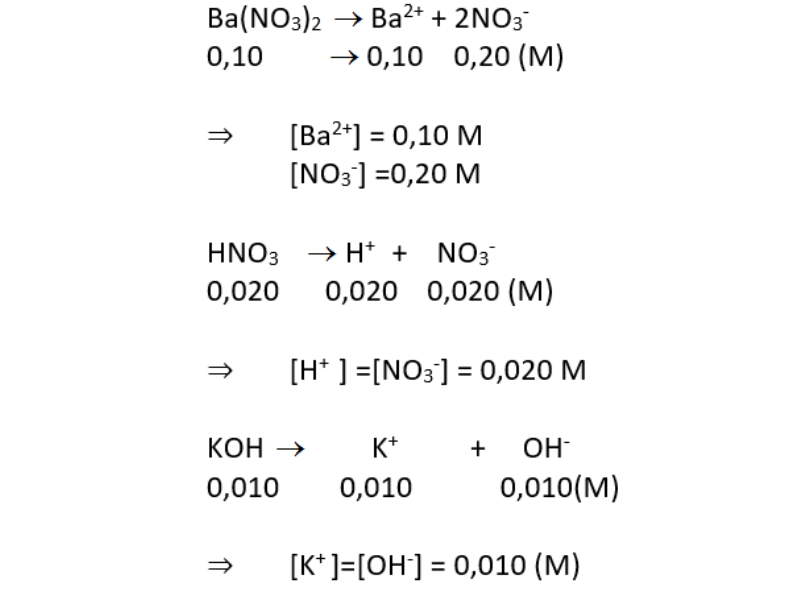
Chất điện ly yếu: hchlor, hno2
hclo ⇌ h+ + clo-
hno2 h+ + no2-
Giải bài 4 Trang 7 SGK Hóa học 11
Chọn đáp án đúng trong các câu sau:
Dung dịch điện phân dẫn điện vì:
A. Sự chuyển động của các electron.
Cation thay thế.
Sự dịch chuyển của các phân tử hòa tan.
Sự chuyển vị của cation và anion.
Giải:Đáp án d.
Do sự hòa tan (trong nước), các phân tử chất điện ly bị phân hủy thành cation và anion.
Giải bài 7 SGK toán 5 lớp 11
Chất nào sau đây không dẫn điện?
A. Kali clorua khan, rắn.
Cacl2 nóng chảy.
Không nóng chảy.
hbr dễ tan trong nước.
Lời giải: Đáp án a.
Khan tồn tại trong một mạng ion rất ổn định do kali clorua rắn. Do đó, chúng không thể phân ly các ion dương và ion âm (di chuyển tự do), do đó chúng không thể dẫn điện.
Như vậy, bài viết này giúp người đọc giải đáp các thắc mắc về sự điện li, bao gồm: chất điện li là gì, chất điện li là gì và cách phân biệt chất điện li mạnh, chất điện li yếu bằng một số bài tập thực hành về chủ đề. monkey Hy vọng thông tin này hữu ích cho bạn. Nhấn “Nhận thông tin cập nhật” để không bỏ lỡ nhiều sự thật thú vị khác về hóa học mỗi ngày!
-
-
-
-
Nguồn: https://anhvufood.vn
Danh mục: Giáo Dục